水的电离平衡
内容
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O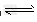 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
室温下,在pH=12的某溶液中,由水电离的c(OH-)为 [ ] A.1.0×10-7mol/L
B.1.0×10-6mol/L
C.1.0×10-2mol/L
D.1.0×10-12mol/L向pH=6的蒸馏水中加入一定量的稀H2SO4,保持温度不变,测得溶液的pH=2。下列关于该溶液的叙述错误的是 [ ] A.该温度高于25℃
B.由水电离出来的c(H+)=1×10-10mol/L
C.c(H+)=c(OH-)+2 c(SO42-)
D.该温度下,向该溶液中加入等体积的pH=12的NaOH溶液,反应后溶液呈中性设水的电离平衡线如图所示。 
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则
Ba(OH)2溶液和盐酸的体积比为__________。下列四种溶液中,由水电离生成的氢离子浓度之比(①∶②∶③∶④)是 [ ] ①1mol/L的盐酸 ②PH=1的醋酸溶液 ③0.01 mol·L-1的NaOH溶液 ④PH=11的NH3·H2O溶液
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶325℃时,某溶液中,由水电离出的c(H+)=1×10-12mol·L-1,则该溶液的c(H+)可能是 [ ] A.1×10-12 mol·L-1
B.1×10-7 mol·L-1
C.1×10-6 mol·L-1
D.1×10-2 mol·L-1下列说法或表示方法正确的是 [ ] A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3kJ
B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知金刚石比石墨稳定
C.相同温度下,①pH=5的NH4Cl溶液、②pH=4的稀盐酸中由水电离出的c(H+):①<②
D.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+) > c(CH3COO-)已知水在25℃和95℃时,其电离平衡曲线如图所示 
(1)则25℃时水的电离平衡曲线应为_____(填“A”或“B”)请说明理由_______________________。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是______________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:______________________。NH3和CO是重要的化工原料气。
(1)一定条件下,CO与H2反应可制得甲醇CO+2H2 CH3OH
CH3OH
图1表示该反应进行过程中的能量变化(曲线a未使用催化剂,曲线b使用催化剂)。图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
①根据上图1,写出在该条件下CO制备甲醇的热化学反应方程式__________________________
②根据上图2计算该该温度下,反应CO(g)+2H2(g) CH3OH(g)的平衡常数为_________________
CH3OH(g)的平衡常数为_________________
③图2所示的具体反应,若在温度保持不变、恒压情况下(体积可变)达到平衡,则H2的平衡转化率将
__________ (填“增大”、“减小”或“不变”)。
(2)已知:
a.常温下,CH3COOH和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH + NaHCO3=CH3COONa+ CO2↑+ H2O
则NH4HCO3溶液呈______性(填“酸”、“碱”或“中”),溶液中浓度最大的离子是______,其次是
_______(以上填化学式)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸,直至盐酸过量。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为_____________
A. 盐酸不足,氨水剩余 B. 氨水与盐酸恰好完全反应 C. 盐酸过量
②实验过程中,H2O的电离程度先_______后________(填“增大”、“减小”或“不变”)。试回答下列问题(温度均为25℃时):
(1)将0.2mol/L HB溶液与0.1mol /L MOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+)_________0.2 mol /L HB溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)(2)pH=13的Ba(OH)2溶液aL与pH=3的HCl溶液bL混合。若所得混合溶液呈中性,则a∶b=_________;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为_______________________。下列有关说法,正确的是 [ ] A.电解质溶于水一定放出热量
B.可逆反应在加热时正逆反应速率都增大
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.25℃时,0.01mol/L的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的积为10-14水的电离过程为H2O  H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=
2.1×10-14。则下列叙述正确的是[ ] A.c(H+)随温度的升高而降低
B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃)
D.水的电离是吸热的过程已知水在25℃和95℃时,其电离平衡曲线如图所示 
(1)则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由_____________________
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________
(3)95℃时,0.1mol/L的NaOH溶液的PH为____________
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后,溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________水的电离平衡曲线如图所示 
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_________增加到_________。
(2)将常温下的pH=8的Ba(OH)2溶液升至100℃,则Ba(OH)2溶液的PH:______________。
A.>10 B.= 6 C.6~8 D.> 8 E.不能确定
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度幂。在某温度下,Ca(OH)2的浓度为0.02mol·L -1,其离子积为______________。将纯水加热至80℃,下列叙述正确的是 [ ] A.水的离子积不变
B.水的pH变小,呈酸性
C.水的pH变大,呈中性
D.水中的c(H+)=c(OH-)>1×10-7mol/L水的电离平衡如图所示 
(1)若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从_____增加到_____。
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃时的恒温,于是混合物溶液的pH=7,则Ba(OH)2与盐酸溶液的体积比______
(3)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是___________已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入
NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是[ ] A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性常温下,将0.02molKOH和0.1molNH4Cl溶于水配成1L溶液,
(1)用离子方程式表示该溶液中存在的三个平衡体系:___________________________、___________________________、___________________________。
(2)溶液中共有___________种不同的粒子。
(3)这些粒子中浓度为0. 1mol/L的是_____________,浓度为0.02mol/L的是_____________。
(4)物质的量之和为0.1mol的二种粒子是__________________。某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时其中的c(OH-)为___________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)为____________。 A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。
要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________;
(3)写出0.1 的A2溶液中离子浓度大小排序 ________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为__________。不同温度下水的电离平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列正确的是 [ ] A.c(H+)随温度的升高而降低
B.水的电离过程是吸热的
C.水的电离平衡常数与浓度、温度有关
D.在35℃时,c(H+) > c(OH-)把1mL0.1mol/L的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于 [ ] A.1×10-4mol/L
B.1×10-8mol/L
C.1×10-11mol/L
D.1×10-10mol/L25℃时,1L 0.01mol/LHCl溶液,水的离子积常数Kw为_______,溶液中H+的物质的量浓度为_______,水电离出的H+的物质的量浓度为_________,向上述溶液中加入1L 0.008mol/L的NaOH溶液,反应后溶液的pH为_________。 水的电离过程为H2O  H++OH-,在25℃时水的离子积为:KW=1.0×10-14,在35℃时水的离子积为:KW=2.1×10-14,则下列叙述正确的是
H++OH-,在25℃时水的离子积为:KW=1.0×10-14,在35℃时水的离子积为:KW=2.1×10-14,则下列叙述正确的是[ ] A.水的电离是个吸热过程
B.35℃时c(H+)<c(OH-)
C.c(H+)随着温度的升高而降低
D.35℃时的水比25℃时的水电离程度小某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)为__________mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4 mol·L-1,则溶液中c(OH-)=__________mol·L-1,由水电离产生的c(H+)=
__________mol·L-1,此时温度__________(填“高于”、“低于”或“等于”)25℃。温度t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,
请回答下列问题:
(1)该温度下水的离子积常数Kw=__________。
(2)该NaOH溶液中NaOH的物质的量浓度为__________,该NaOH溶液中由水电离出的c(OH-)为__________。
(3)给该NaOH溶液加热,pH__________(填“变大”,“变小”或“不变”)。
(4)该温度下若a=8,要中和该NaOH溶液500 mL,需pH=2的盐酸溶液的体积为__________。下列说法正确的是 [ ] A.25℃水的电离常数是1.0×10-14
B.中性溶液的c(H+)=
C.纯水在100℃时,c(H+)>10-7mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液水的电离过程为H2O  H++OH-,在25℃时,水的离子积:Kw=1×10-14,在35℃时,水的离子积:
H++OH-,在25℃时,水的离子积:Kw=1×10-14,在35℃时,水的离子积:
Kw(35℃)=2.1×10-14,则下列叙述正确的是[ ] A.c(H+)随着温度的升高而降低
B.35℃时,c(H+)<c(OH-)
C.35℃时的水比25℃时的水电离程度小
D.水的电离是吸热的常温下0.01 mol/L NaOH溶液中的c(H+)是0.0005 mol/LBa(OH)2溶液中c(H+)的 [ ] A.10倍
B.20倍
C.1/10倍
D.1/20倍当把两种水(D2O、H2O)混在一起,则混合后溶液中存在的分子为__________,存在的阳离子为
__________________(写成水合的形式),存在的阴离子为__________________。两种水的电离方程式为
__________________,___________________。水是一种极弱的电解质,在室温下水的电离常数为1.8×10-16,若平均每n个水分子只有一个水分子能电离,则n是 [ ] A.1×10-4
B.55.6×107
C.1×107
D.6.02×1021在pH=9的NaOH溶液和CH3COONa溶液中,设由水电离出的OH-浓度分别为M和N,则M和N的关系为 [ ]
A.M>N
B.M=10-4N
C.N=10-4M
D.M=N将纯水加热至较高温度,下列叙述正确的是 [ ] A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变大、pH变小、呈中性
D.水的离子积变小、pH变大、呈碱性下列各选项中所述的两个量,前者一定大于后者的是 [ ] A.2mol H2(g)和2mol I2(g)与4mol H2(g)和4mol I2(g)分别充入两个恒温恒容的容器中反应达到平衡时H2的转化率
B.物质的量浓度相等的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度
C.用量筒量取液体时,仰视的读数和俯视的读数
D.物质的量浓度相等的CH3COONa溶液和Na2CO3溶液中水的电离程度在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为 [ ]
A.A>B
B.A=10-4B
C.B=10-4A
D.A=B下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 [ ] A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的
c(HCO3-)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是________。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快 B.H2SO4最快 C.CH3COOH最快 D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:
①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是_____________________。
(4)已知:酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B.c(HCO3-)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO32-)+c(ClO-)+c(OH-)+c(CO32-)设水的电离平衡线如下图所示 
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃ 的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________ 。25℃时,将0.01 mol  和0.002 mol
和0.002 mol 溶于水,形成1L混合溶液:
溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①______________________;②_______________________;③______________________。
(2)溶液中共有七种不同的粒子(指分子和离子)。在这些粒子中,浓度为0.01 mol/L的是________,浓度为0.002 mol/L的是___________;____________和____________两种粒子物质的量之和等于0.01mol。在水的电离平衡中,  和
和 的关系如下图所示
的关系如下图所示
(1)A点水的离子积为1×10-14,B点水的离子积为____________________。造成水的离子积变化的原因是______________________。
(2)25℃时,H2R在水溶液中的电离方程式为: 。
。
① 0.1 mol/LH2R溶液的pH________1(填“>”.“<”或“=”)。
②在0.1 mol/L 溶液中,各离子浓度由大到小的顺序是:_____________________。
溶液中,各离子浓度由大到小的顺序是:_____________________。
(3)100℃时,0.01 mol/L 溶液的pH =_________________。
溶液的pH =_________________。
(4)100℃时,将pH =8的 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=
7,则 溶液与盐酸的体积比为____________________。
溶液与盐酸的体积比为____________________。 25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度和水电离出的OH-离子浓度之比为 [ ]
A.1010:1
B.5×109:1
C.108:1
D.1:1下表是不同温度下水的离子积数据 
试回答以下问题
(1)若25<t1<t2,则a________1×10-14 (填“>”、“<”或“=”),作此判断的理由是________________________。
(2)25℃下,某Na2SO4溶液中 =5×10-4 mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)=____________。
=5×10-4 mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)=____________。
(3)在t2 ℃下,pH = 10的NaOH溶液中,水电离产生的OH-浓度为c(OH-)水=______________。
(4)t2 ℃下,将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH = 2,则V1∶V2 =_______________,此溶液中各种离子的浓度由大到小的排列顺序:______________________________在某温度时,水的离子积为1×10-12,若该温度下某溶液中H+浓度为1×10-7mol·L-1,则该溶液 [ ]
A.呈碱性
B.呈酸性
C.呈中性
D.c(OH-)=100c(H+)在约100℃的温度下,NaCl稀溶液中c(H+)=1.0×10-6 mol·L-1。下列说法中正确的是 [ ] A.该溶液呈酸性
B.该溶液呈中性
C.该溶液的KW=1.0×10-12
D.该溶液的KW=1.0×10-14水的电离过程为H2O  H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:
H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:
KW(35℃)=2.1×10-14,则下列叙述正确的是[ ] A.c(H+)随着温度的升高而降低
B.35℃时,c(H+)<c(OH-)
C.35℃时的水比25℃时的水电离程度小
D.水的电离是吸热的当把两种水(D2O、H2O)混在一起,则混合后溶液中存在的分子为__________,存在的阳离子为
__________________(写成水合的形式),存在的阴离子为__________________。两种水的电离方程式为___________________,_____________________。
- 1书面表达(满分30分)假定你是李华,你们学校和美国一所学校签订了教师交换协议。在过去的一年里,你们的老师是来自这所学校的
- 2北京奥运会期间,志愿者使用的快餐盒内层是用铝箔包裹并已加工好的真空包装食品,外层则是分别包装的两包化学物质,吃饭前拉动预
- 3已知函数,过点作曲线的切线,求切线方程.
- 4如图所示,是表示光在物体表面反射的情况,图中________是反射光线,________是法线,________是入射角
- 5下列词语中,没有错别字的一项是[ ]A.震慑 金箍咒 无暇顾及 城门失火,殃及池鱼 B.谜团 掉书袋 皇天厚土
- 6Nowadays many housewives prefer to go to supermarkets for th
- 7化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中不属于这种情况的是( )A.过量的Mn
- 8我们在通常情况下,从各个方向都能看到黑板上的字时,是因为发生了光的 _____;而黑板某一小部分“反光”是由于光线射到这
- 9某研究性学习小组设计了实验来探究光合作用的原料和产物.步骤如下:①在广口瓶中加入蒸馏水至如图所示位置(蒸馏水加热后迅速冷
- 10化学课上,老师向盛有少量碳酸钠溶液的试管中加入一定量的澄清石灰水,出现了白色沉淀,反应的化学方程式是Na2CO3+Ca(
- 1某元素的一种微粒的结构示意图为,下列说法不正确的是( )A.该元素是一种金属元素B.该微粒是阳离子C.该微粒具有稳定结
- 2被子植物就是我们常见的绿色开花植物,与人类生活关系密切,请你说出几种常见的被子植物?
- 3When I crossed a small road on my first day in Kolkata, I wa
- 4某实验小组在做“验证机械能守恒定律”实验中,提出了如图所示的甲、乙两种方案:甲方案为用自由落体运动进行实验,乙方案为用小
- 5下列说法正确的是A.液化石油气和天然气的主要成分都是甲烷B.糖类、脂类、蛋白质都属于天然高分子化合物C.汽油、煤油、植物
- 6二次函数的图象如图所示,反比例函数与一次函数在同一平面直角坐标系中的大致图象是 A.B.C.D.
- 7科学家发现,冰天雪地的南极大陆下面竟然埋藏着丰富的煤炭,对于这一事实成因的解释,合理的是[ ]A.气候变暖
- 8从2009年1月1号开始,我国开始增收燃油税,这一改革最主要的目的是[ ]A.减轻消费者的负担B.建设资源节约型
- 9语言运用。(12分)有位主人请客,约定的时间就要到了,但只来了三位客人,主人很是着急,自言自语道:“怎么回事,该到的还没
- 10如图是洋葱表皮细胞装片的几个步骤,请回答:(1)图中操作步骤的正确顺序是______.(2)图B表示染色的过程,所使用的
