百科
化学平衡的移动和应用
化学平衡移动的含义
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,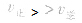 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动;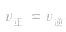 ,化学平衡不移动;
,化学平衡不移动;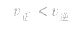 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。
化学平衡状态
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到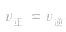 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
特征
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等: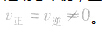 。
。
(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使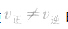 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
相关试题
有如下的可逆反应:X(g)+2Y(g)  2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107帕,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是
2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107帕,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是
[ ] A.100℃
B.200℃
C.300℃
D.不能确定一定温度下,某密闭容器里发生如下反应:CO(g) + H2O(g)  CO2(g) + H2(g)(正反应为吸热反应),当反应达到平衡时,测量容器中各物质的物质的量均为n mol,欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是
CO2(g) + H2(g)(正反应为吸热反应),当反应达到平衡时,测量容器中各物质的物质的量均为n mol,欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是[ ]
①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
A.①②
B.②④
C.③④
D.①②③某可逆反应L (s)+G(g)  3R(g);ΔH>0。下图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
3R(g);ΔH>0。下图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
[ ] A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率反应N2O4(g)  2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
[ ] A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C下列说法正确的是 [ ] A.把NaHCO3和Na2CO3混和物6.85 g溶于水制成100 mL溶液,其中c(Na+)=1 mol·L-1. 该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.将54.4 g铁粉和氧化铁的混合物中加入4.0mol/L200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生, 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42+ 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)  Z(g)+W(s);△H<0下列叙述正确的是
Z(g)+W(s);△H<0下列叙述正确的是[ ] A.增加少量W,正反应速率减小
B.当容器中气体的密度不变时,反应达到平衡
C.降低温度,平衡不移动
D.平衡后加入Z ,上述反应的△H减小在一固定容积的密闭容器中充入1molNO2,一定温度下建立如下平衡:2NO2  N2O4,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是
N2O4,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是[ ] A.x>y
B.x<y
C.x=y
D.不能确定在298℃时,2SO2(g)+O2(g)  2SO3(g);△H= -197kJ/mol,在相同温度和压强下,向一容积可变的密闭容器中通入2molSO2和1molO2,达到平衡时,放热Q1,向另一相同密闭容器中通入1molSO2和0.5molO2,达平衡时放热为Q2,则下列关系正确的是
2SO3(g);△H= -197kJ/mol,在相同温度和压强下,向一容积可变的密闭容器中通入2molSO2和1molO2,达到平衡时,放热Q1,向另一相同密闭容器中通入1molSO2和0.5molO2,达平衡时放热为Q2,则下列关系正确的是 [ ] A.Q1<Q2<197kJ
B.Q1=Q2=197kJ
C.2Q2<Q1<197kJ
D.2Q2=Q1<197kJ在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)  2C(g),ΔH<0若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
2C(g),ΔH<0若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
[ ] A.③②①
B.③①②
C.①②③
D.②①③如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)  2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
[ ] A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B.达到平衡后,隔板K最终停留在左侧刻度0~2之间
C.到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处下图表示反应A(气)+B(气)  nC(气);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是
nC(气);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是
[ ] A.反应由逆反应开始
B.a表示有催化剂,b表示无催化剂
C.若n=2,其它条件相同,a比b的压强大
D.若其它条件相同,a比b的温度高在一个固定体积的密闭容器中,向容器中充入2molA和1molB,发生如下反应: 2A(g)+B(g)  3C(g)+D(s),反应达到平衡时C的浓度为1.2mol/L。
3C(g)+D(s),反应达到平衡时C的浓度为1.2mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2mol/L的是_________(用序号填空)
①4molA+2molB ②3molC+1molD+lmolB
③3molC+2molD ④1.6molA+0.8molB+0.6molC
⑤2molA+1molB+1molHe
(3)某温度下,向容器中加入3molC和0.8mo1D,反应达到平衡时C的浓度仍为1.2mol/L,则容器的容积V应大于_________L,小于________L。下列说法中正确的是 [ ]
A.在一体积不变的密闭容器中,反应2NO2(g)  N2O4(g) ΔH<0,达平衡后加热,容器内气体的平均摩尔质量减小,但气体的密度不变
N2O4(g) ΔH<0,达平衡后加热,容器内气体的平均摩尔质量减小,但气体的密度不变
B.在一体积和温度不变的容器中,进行反应H2(g)+I2(g) 2HI(g) ΔH<0,若容器内的压强不变,表明反应已达平衡状态,且反应从开始至达到平衡状态的过程中,容器向外放热
2HI(g) ΔH<0,若容器内的压强不变,表明反应已达平衡状态,且反应从开始至达到平衡状态的过程中,容器向外放热
C.在一温度和压强不变的密闭容器中,充入一定量的SO3发生反应2SO3 (g) 2SO2(g)+O2(g),达平衡后,再向容器中充入一定量的SO3,重新达到平衡时,SO3的体积分数增加
2SO2(g)+O2(g),达平衡后,再向容器中充入一定量的SO3,重新达到平衡时,SO3的体积分数增加
D.四个体积相等的密闭容器,四位同学分别于不同的温度下,按物质的量1:3的比例在其中分别充入等量的N2和H2合成氨,当反应进行到10分钟时,每人均测定各自四个容器中NH3的体积分数并分别作图如下,则图2肯定错误
对于反应N2O4(g)  2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是 
[ ] A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需时间为x;维持p2不变, D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1甲、乙、丙、丁四种物质在一定条件下均能与水反应放出气体。
(1)若甲是由短周期元素形成的单质,并且该元素的原子最外电子层上的电子数为其内层电子层数的二分之一,则甲元素的原子结构示意图为____________,甲与水反应的离子方程式为_________________;
(2)乙为甲的稳定的氧化物,写出乙在与水反应中氧化剂的电子式____________;19.5g乙与足量的水反应转移电子的物质的量为____________mol;
(3)丙为地壳中金属元素含量排位第二的元素形成的单质,写出它与水蒸气反应的化学方程式________________________;在实验室里,配制丙的高价氯化物溶液时要加入一定量的盐酸,解释原因并写出离子反应方程式:________________________;
(4)丁是由两种均为10个电子的微粒组成的化合物,它与碱反应能生成一种有刺激性气味的气体X,X分子中也含有10个电子,则丁属于____________类型的晶体,从综合效益角度出发,在工业上生产X时,既要增大单位时间内X产量,又要提高X的产率,可采取的措施是(填写下列合理选项的序数)
_______________。
①减压 ②加压 ③升温 ④降温 ⑤适宜的温度和压强 ⑥加催化剂
⑦及时从平衡体系中分离出X ⑧分离出X后的原料气循环使用并补充原料有某可逆反应aA(g)+bB(g)  cC(g) △H=Q kJ/mol;下图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是
cC(g) △H=Q kJ/mol;下图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是 
[ ] A.a+b<c时,y轴表示平衡混合气中C的质量分数
B.a+b<c时,y轴表示平衡混合气的平均摩尔质量
C.△H>0时,y轴表示达到平衡时B的转化率
D.△H<0时,y轴表示达到平衡时A的转化率有下列五个化学方程式(X、Y、Z均为正值)
①C2H2(g)+H2(g) C2H4(g)
C2H4(g)
②CH4(g) H2(g)+1/2C2H4(g)
H2(g)+1/2C2H4(g)
③C(s)+2H2(g) CH4(g);△H=-X kJ·mol-1
CH4(g);△H=-X kJ·mol-1
④C(s)+1/2H2(g) 1/2C2H2(g);△H=-Y kJ·mol-1
1/2C2H2(g);△H=-Y kJ·mol-1
⑤C(s)+H2(g) 1/2C2H4(g);△H=-Z kJ·mol-1
1/2C2H4(g);△H=-Z kJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是[ ] A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Z>X>Y将1mol H2(g)和2mol I2 (g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)  2HI(g);
2HI(g);
ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是
[ ] A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积工业制取硫酸有一步重要反应是SO2在400~500°C下的催化氧化,2SO2+O2  2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是[ ] A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%的转化为SO3
C.为了提高SO2的转化率,应适当提高O2的浓度
D.达到平衡时,SO2的浓度与SO3的浓度相等在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: 
下列说法错误的是 [ ] A.反应达到平衡时,X的转化率为50%
B.上述反应为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数不变
D.若改变温度反应的平衡常数变大,则一定为升高温度t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:
3A (g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为
xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为
0.4mol/L,请填写下列空白:
(1)v(B)=___________mol/(L·min), v(C)=___________mol/(L·min),x=___________。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=________________;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
____________(填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率保持不变在一定条件下,可逆反应:aA+bB  cC达到平衡,若:
cC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则a+b和c的关系是______________。
(2)A、C是气体,增加B的量,平衡不移动,则B为_____________态。
(3)A、C是气体,而且a+b=c,增大压强可使平衡发生移动,则平衡移动的方向是______________。
(4)加热后,可使C的质量增加,则正反应是___________反应(填“放热”或“吸热”)。某温度下,在容积固定不变的密闭容器中发生下列可逆反应: X(g)+2Y(g)  2Z(g)。平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、
2Z(g)。平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、
1 mol、2 mol的X、Y、Z,则下列叙述中正确的是[ ] A.刚充入时,反应速率ν (正)减小,ν (逆)增大
B.达到新平衡时,容器内气体的平均相对分子质量增大
C.达到新平衡时,容器内气体的压强是原来的两倍
D.达到新平衡时,容器内气体的百分组成和原来相同在体积相同的A、B两个带活塞的玻璃容器中,分别注入1/4体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到1/2(快速),过一会可以看到 [ ]
A.A中的颜色比B中的浅
B.A中的颜色比B中的深
C.A中的颜色与B中的深浅相同
D.A中颜色比开始时深一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比  的关系如图1。改变温度和压强,生成物Z的百分含量如下表,则该反应的化学方程式可表示为
的关系如图1。改变温度和压强,生成物Z的百分含量如下表,则该反应的化学方程式可表示为

[ ] A.3X(g)+Y(g)  4Z(g);ΔH>0
4Z(g);ΔH>0
B.X(g) + 3Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
C.3X(g)+Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
D.X(g)+3Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0 对于反应N2O4(g)  2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
[ ] A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)
C.维持p1不变,E→A所需时间为x;维持p2不变, D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)  2NH3(g);△H=-92.0KJ·mol-1将1molN2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为
2NH3(g);△H=-92.0KJ·mol-1将1molN2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为
20%。若在相同条件下,起始时在该容器中充入2molNH3,反应达到平衡时的热量变化是[ ] A.吸收18.4KJ热量
B.放出18.4KJ热量
C.吸收73.6KJ热量
D.放出73.6KJ热量在一定条件下化学反应:2SO2(g)+O2(g)  2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列
2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列
根据以上数据,下列叙述不正确的是 [ ] A.2SO2(g)+O2(g)  2SO3(s);△H=-QkJ/mol Q<197kJ
2SO3(s);△H=-QkJ/mol Q<197kJ
B.在上述条件下每消耗2摩SO2气体时放出的热量为197kJ
C.在上述条件下反应生成1molSO3气体放热98.5kJ
D.2Q2=2Q3反应A+2B  2C(g);正反应为放热反应。当反应达到平衡后,同时升高温度和减小压强达到新的平衡,若新平衡时混合物C的含量与原平衡相同,则下列推断正确的是
2C(g);正反应为放热反应。当反应达到平衡后,同时升高温度和减小压强达到新的平衡,若新平衡时混合物C的含量与原平衡相同,则下列推断正确的是 [ ] A.B一定不是气态物质
B.A一定不是气态物质
C.达到新平衡后升高温度,正反应速率减慢,逆反应速率加快
D.达到新平衡后加入B,平衡向正反应方向移动一定条件下,向一容积可变的密闭容器中充入2mol X,发生反应2X(g)  Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡平衡浓度不变的是
Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡平衡浓度不变的是 [ ] A.恒温恒压下,充入1 molX(g)
B.恒温恒容下,充入1 molY(g)
C.恒温恒压下,充入2 mol Z(g)
D.恒温恒压下,充入1 mol He(g)一定量的混合气体,在密闭容器中发生如下反应:达平衡后,将体积缩小到原来的1/2,当达到新平衡状态时,B的浓度为原来的1.9倍,若压缩过程保持温度不变,则下列叙述正确的是 [ ] A.A的转化率降低
B.m+n>P
C.平衡向逆反应方向移动
D.新平衡时,A的浓度比原平衡时A的浓度小下列说法正确的是 [ ] A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其它条件不变时,升高温度可以使平衡向放热反应方向移动
D.在其它条件不变时,增大压强一定会破坏气体反应的平衡状态在容积固定的密闭容器中存在如下反应:A(g)+3B(g)  2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图
2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图
下列判断正确的是 [ ] A.图I研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高有下列五个化学方程式(x、Y、Z均为正值):
①C2H2(g)+H2(g) C2H4(g)
C2H4(g)
②CH4(g) H2(g)+1/2C2H4(g)
H2(g)+1/2C2H4(g)
③C(s)+2H2(g) CH4(g);△H= -X kJ·mol-1
CH4(g);△H= -X kJ·mol-1
④C(s)+1/2H2(g) 1/2C2H2(g);△H= -Y kJ·mol-1
1/2C2H2(g);△H= -Y kJ·mol-1
⑤C(s)+H2(g) 1/2C2H4(g)△H= -ZkJ·mol-1
1/2C2H4(g)△H= -ZkJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是[ ] A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Z>X>Y在一定温度下,容器内某一反应中M、 N的物质的量随反应时间变化的曲线如图,下列表述中正确的是 
[ ] A.t1时,N的浓度是M浓度的2倍
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.反应的化学方程式为:2M N
N 在一密闭容器中,加入物质A和B后发生反应aA(s)+bB(g)  cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是
cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是[ ] A.升高温度时,正反应速率加快,逆反应速率减慢
B.增加少量的A物质,正反应的化学反应速率加快
C.增大压强,化学反应速率加快
D.达到平衡时消耗B的物质的量一定等于消耗C的物质的量如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放
100mL 6mol/L的HCl溶液,烧杯乙中盛放100mL冷水。现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解。
(1)A瓶中气体颜色______________,理由是__________________________。
(2)B瓶中气体颜色______________,理由是__________________________。反应A(g)+3B(g)  2C(g)(正反应为放热反应),达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2C(g)(正反应为放热反应),达平衡后,将气体混合物的温度降低,下列叙述中正确的是[ ] A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动3A(g)  3B(?)+C(?)(正反应为吸热反应).随着温度的升高,气体的平均相对分子质量有变小趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应).随着温度的升高,气体的平均相对分子质量有变小趋势,则下列判断正确的是[ ] A.B和c可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体二氧化氮存在下列平衡:2NO2(g)  N2O4(g),△H<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是
N2O4(g),△H<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是[ ] A.温度130℃、压强3.03×105Pa
B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104Pa
D.温度0℃、压强5.05×105Pa对苯二酚是摄影业中常用显影剂,它在水中电离出的阴离子对已曝光的AgBr有显影作用,有关变化可表示为: 
则在以对苯二酚为主要成分的显影液中,能使显影速度明显加快的添加剂是 [ ] A.KBr
B.CH3COOH
C.Na2CO3
D.H2O在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:
aA(g)+bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 
[ ] A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) = Si(s)+4HCl(g)  mol(Q>0) 某温度.压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
mol(Q>0) 某温度.压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 [ ] A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1.K3分别充人A.B中,反应起始时,A.B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0) 
(1)一段时间后,反应达到平衡,此时A.B中生成的N2O4的速率是VA_________VB。(填“>”.“<”.“=”);若打开活塞K2,气球B将__________(填:变大.变小.不变)。
(2)若在A.B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小.不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填: 变大.变小.不变)。
(3)室温下,若A.B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________在容积一定的密闭容器中发生可逆反应A(g)+2B(g)  2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是
2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是 
[ ] A.P1>P2,纵坐标指A的质量分数
B.P1>P2,纵坐标指C的质量分数
C.P1<P2,纵坐标指A的转化率
D.P1<P2,纵坐标指混合气体的平均摩尔质量下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是 [ ] A.2NO2  N2O4 (正反应为放热反应)
N2O4 (正反应为放热反应)
B.C(s)+ CO2 2CO (正反应为吸热反应)
2CO (正反应为吸热反应)
C.N2+3H2 2NH3 (正反应为放热反应)
2NH3 (正反应为放热反应)
D.H2S H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
最新试题
- 1已知D、E分别是△ABC的边AB、AC上的点,若要使△ABC与△ADE相似,则只需添加一个条件( )即可(只需填写
- 2小立身高1.60m,站在镜前0.50m处,则他在镜中的像离镜面 m,像高 m;当他慢慢远离镜子时,像的大
- 3Teenagers _______ allowed to drive in the street .A.should n
- 4(12分)如图所示是中学实验室中的手摇发电机,与摇把相连的大轮的直径为20cm,与转子相连的小轮直径为2cm。已知永磁铁
- 5设椭圆C1:=1(a>b>0)的左、右焦点分别为为,恰是抛物线C2:的焦点,点M为C1与C2在第一象限的交点,且|MF2
- 6浸没在液体中的物体,同时受到重力和浮力,如果物体上浮,则说明重力______浮力;如果物体下沉,则说明重力______浮
- 7在农村常见马和驴杂交产下骡的情况。有人认为,马和驴属于一个种;也有人认为,马和驴不是一个种。你支持哪一种观点?说明理由。
- 8阅读下面材料,根据要求作文。 美国作家克里腾登写过一篇题为《母亲的价格》的文章,指出如果母亲的日常工作可获薪水,合理的
- 9Raising pets is a popular online game among teenagers. "More
- 10制作泡菜过程中皿硝酸盐的含量变化是[ ]A.先减少后增加B.先增加后减少C.逐渐增加D.逐渐减少
热门考点
- 1下列有关细胞结构和功能的叙述,错误的是[ ]A.若细胞同时有内质网和中心体,则该细胞一定是动物细胞B.若细胞同时
- 2代数式的值不小于的值,那么a的取值范围是 [ ]A、a≥-1B、a≥1C、a≥2D、a≤1
- 3德国天文学家开普勒,一生多灾多难,天花病把他弄得疤痕累累,猩红热又弄坏了他的眼睛,后来又因父亲欠债而被迫失学,但他不屈不
- 4下列关于内能说法正确的是[ ]A.运动的物体比静止的物体内能大B.温度高的物体一定比温度低的物体内能大C.-20
- 5如图所示,每个钩码质量相等,轻杠杆处于平衡状态,若在两边钩码下各再挂上一个相同的钩码,这时( )A.杠杆仍在水平位置平
- 6在血液成分中,能够释放促使血液凝固物质的是( )A.红细胞B.白细胞C.血小板D.5%的柠檬酸钠溶液
- 7已知函数f(x)=13x3+12ax2+bx+1(x∈R,a,b为实数)有极值,且x=-1处的切线与直线x-y+1=0平
- 8质量为10 kg的物体,在变力F作用下沿x轴做直线运动,力随位移x的变化情况如图所示。物体在x=0处速度为1 m/s,一
- 9依次填入下面一段文字横线处的语句,衔接最恰当的一组是 (3分)我们不再一己呢喃,也不满足于窃窃私语。我们要让声音在阳光
- 10交流电源输出的电压U 随时间t 变化的图线如图所示,则下列说法正确的是A.交变电流的频率为50HzB.交变电压的最大值C

 2NH3的正反应速率加快的是
2NH3的正反应速率加快的是  2C(g)(正反应放热)。这个可逆反应的正确图像为
2C(g)(正反应放热)。这个可逆反应的正确图像为



 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是