中和滴定实验
酸碱中和滴定
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,
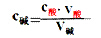
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图:
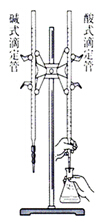
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
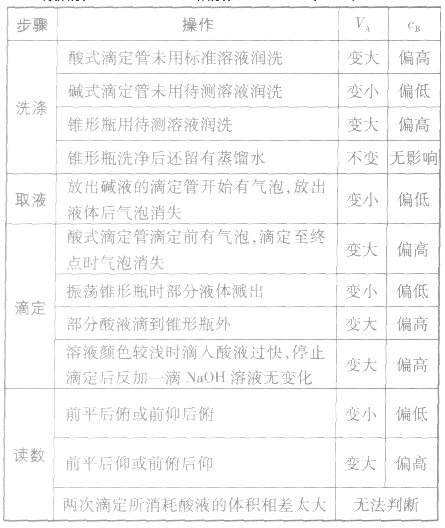
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由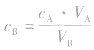 可知,VB是准 确量取的体积,CA标准溶液的浓度,它们均为定值,所以CB的大小取决于VA的大小,VA大则CB大,VA小则CB小。
可知,VB是准 确量取的体积,CA标准溶液的浓度,它们均为定值,所以CB的大小取决于VA的大小,VA大则CB大,VA小则CB小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表:
中和滴定应注意的问题
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
- 用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸,有关关系如图所示,据图推出
NaOH溶液和盐酸的物质的量浓度是
[ ]
C(HC1)(mol·L-1) C(NaOH)(mol·L-1)
A. 0.12 0.04
B. 0.04 0.12
C. 0.18 0.06
D. 0.09 0.03 - (1)根据下列仪器回答问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯 F、蒸发皿 G、分液漏斗
①有温度标志的有_________(填序号);
②使用时必须检查是否漏水的有____________(填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有____________(填序号);
(2)现用物质的量的浓度为amol / L的标准NaOH溶液去测定VmL盐酸的物质的量浓度,下图是碱式滴定管中液面在滴定前后的读数:
c(HCl)=_______________ - 用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的[ ]
A.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
B.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
C.酸式滴定管未用标准盐酸溶液润洗
D.把氢氧化钠待测液移入锥形瓶中时,有少量碱液溅出 - 实验室现有3种酸碱指示剂,其pH变色范围如下甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用
0.10 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 [ ]
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂 - 用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是
[ ]
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失 - 实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:
KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:
①向溶液中加入1~2滴指示剂;
②向锥形瓶中加20mL~30mL蒸馏水溶解;
③用NaOH溶液滴定到终点,半分钟不褪色;
④重复以上操作;
⑤准确称量0.4000g~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中;
⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响? ______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
- 1-0.2的倒数是 .
- 2日本将一些工业移往东南亚的原因是A.帮助东南亚国家发展经济B.日本国内缺乏科技人员 C.日本资金短缺D.靠近东南亚的原料
- 3如图所示的四个家系,黑色是遗传病患者,白色为正常或携带者,下列有关叙述正确的是 [ ]A.可能是白化病遗传的家系
- 4下列各句没有语病、内容明确的一项是[ ]A. 国家自从明确了全国统一的“五一”“十一”放假日之后,中国的假日经济
- 5市区内各路口处画有停车线,当信号灯黄灯开启时司机应开始刹车,红灯开启时车不能越过停车线,否则违反交通规则.设黄灯开启经3
- 6函数f(x)=-x3+2ax2+1(a∈R)在区间(0,23)上递增,[23,+∞)上递减,则实数a的值为 _____
- 7—Why? Where is the key to the meeting room? —Dear me! You __
- 8关节活动起来非常灵活,与之有关的结构特点是关节结构里有( )A.关节软骨和韧带B.关节头和关节窝C.关节软骨和滑液D.
- 9如图1,B是长度为1的线段AE上任意一点,在AE的同一侧分别作正方形ABCD和长方形BEFG,且EF=2BE.(1)点B
- 10我国实行计划生育的目的是 [ ] ①控制人口数量 ②晚婚晚育 ③提高人口素质 ④少生优生A.①③B.②③ C.
- 1角α的终边上有一点P(m,5),且cosα=m13,(m≠0),则sinα=( )A.513B.-513C.1213或
- 2下列因式计算得代数式xy2﹣9x的是[ ]A.x(y﹣3)2B.x(y+3)2C.x(y+3)(y﹣3)D.x(
- 3下列各式一定为正数的是[ ]A.(a+b)2B.2004|a|C.a2+b2D.2x2+3x4+
- 4无产阶级第一次武装夺取政权和建立无产阶级专政的伟大尝试是[ ]A.成立巴黎公社B.成立共和国C.组织临时政府D.
- 5近代有一位思想家主张学习西方,在其著作中提出了“物竞天择,适者生存”的观点。这位思想家是[ ]A.詹天佑B.严复
- 6如图5-36所示四个钢铁工业城市,其区位类型与其他三个不同的是( )图5-36
- 7佛教、道教是两种不同的宗教文化,而在我国的南岳衡山,南岳大庙两侧各有八座道观、佛寺,开门相见,香火相通,道士、僧人轮流值
- 8有关我国农业生产的叙述,错误的是( )A.我国农耕区的畜牧业,以畜禽饲养为主B.我国四大牧区指的是内蒙古、新疆、青海、
- 91942年1月26日,《联合国家宣言》发表,宣言由美英苏中四国领衔,其余22国按国名的英文依次排列,这表明( )①
- 10“鸟有反哺之情,羊有跪乳之恩”这句话给我们的启示是( )①我们要从小养成孝敬父母的习惯 ②父母养育了子女,理应得到子女






















 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化











 的值将_________(填“变小”,“变大”或“不变”);
的值将_________(填“变小”,“变大”或“不变”); 