中和热
影响中和热测定的因素
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
内容
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: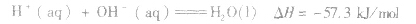
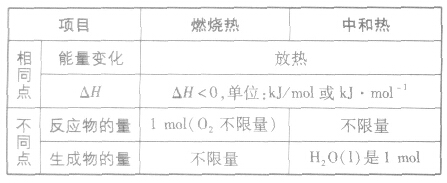
燃烧热和中和热的异同
- 下列说法中正确的是[ ]
A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热
B.用渗析法可除去鸡蛋白溶液中少量的氯化钠杂质
C.铝粉与氧化铁粉末反应中生成物总能量高于反应物总能量
D.H2S的热稳定性小于H2O是由于H2S分子间不存在氢键 - 关于化学能与热能的叙述,正确的是 [ ]
A.1mol酸与碱恰好中和时所放出的热量叫中和热
B.化学反应中的能量变化,主要是由化学键的变化引起的
C.需要加热才能发生的反应,一定是吸热反应
D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 - 已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是[ ]
A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq)
B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq)
C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq)
D.1mol/L稀CH3COOH(aq)和1mol/L稀NaOH(aq) - 已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是[ ]
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 - 1.00L 1.00mol·L-1 H2SO4溶液与2.00L 1.00mol·L-1 NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
- 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为
△H1、△H2、△H3,下列关系正确的是[ ]
A.△H1>△H2>△H3
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3 - 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与
H2反应生成NH3的热化学方程式为_____________________ - 下列关于热化学反应的描述中正确的是 [ ]
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)
kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 - 下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 - 下列说法正确的是[ ]
A.中和热一定是强酸跟强碱反应放出的热量
B.1mol酸与1mol碱完全反应放出的热量是中和热
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D.表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l); △H=57.3KJ/mol - 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ/mol,向1 L 0.5 mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是[ ]
A.ΔH1>ΔH2>ΔH3
B.ΔH1<ΔH3<ΔH2
C.ΔH2>ΔH1>ΔH3
D.ΔH1>ΔH3>ΔH2 - 已知101KPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ/mol,则下列热化学方程式书写正确的是[ ]
①C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = +5518kJ/mol
②C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = -5518kJ/mol
③H+(aq)+ OH-(aq)= H2O(l); △H = -57.3kJ/mol
④1/2H2SO4(aq) + NaOH(aq) =1/2Na2SO4(aq) + H2O(l); △H = +57.3kJ/mol
A.①③
B.②③
C.②④
D.② - 已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是 [ ]
A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq)
B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq)
C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq)
D.1mol/L稀CH3COOH(aq)和1mol/L稀NaOH(aq) - 已知中和热的数值是57.3 kJ·mol-1。下列物质反应时能产生57.3 kJ热量的是[ ]
A.稀HCl和稀NaOH溶液
B.1.0 mol·L-1HCl溶液和1.0 mol·L-1NaOH溶液
C.500 mL 2.0 mol·L-1HC1溶液和500 mL 2.0 moI.·L-1 NaOH溶液
D.500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 moI·L-1Ba(OH)2溶液 - 下列有关H+(aq)+ OH-(aq)=H2O(l);△H=-57.3kJ/mol的离子反应说法正确的是 [ ]
A.代表所有的酸碱中和反应
B.反应物一定是强酸与强碱
C.强酸与强碱的中和反应都可以这样表示
D.代表稀的强酸与稀的强碱反应生成1mol液态水时,放出热量57.3kJ - 已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是[ ]
A. 碳的燃烧热大于110.5kJ/mol
B. ①的反应热为221kJ/mol
C. 稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 - 下列各项表述正确的是 [ ]
A.次氯酸的电子式:
B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l);△H=-57.3kJ/mol
C.H2S电离的方程式为:H2S 2H++S2-
2H++S2-
D.标准状况下,1.12L 和1.12L
和1.12L 均含有0.1
均含有0.1 个氧原子
个氧原子 - 已知:HCN(aq)与NaOH(aq)反应的△H=-12.1 kJ/mol;HClcaq)与NaOH(aq) 反应的△H=-55.6kJ/mol。则
HCN在水溶液中电离的△H等于[ ]
A. -43.5kJ/mol
B. +43.5kJ/mol
C. -67.7 kJ/mol
D. +67.7kJ/mol - 下列说法正确的是 [ ]
A.HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 - 下列关于热化学反应的描述中正确的是 [ ]
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283. 0kJ/mol,则2CO2(g)=2CO(g)+O2(g) 反应的△H =2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 - 下列说法或表示方法正确的是 [ ]
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s) △H=-1. 90kJ/mol可知,金刚石比石墨稳定
C.氢气的燃烧热285. 8kJ/mol,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) △H=+285. 8kJ/mol
D.在稀溶液中H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol。若将含0. 5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3kJ 强酸和强碱稀溶液的中和热表示为H+(aq)+OH-(aq)=H2O(l) △H= -57. 3kJ·mol-1 已知:
[ ]
①HCl(aq) +NH3·H2O(aq)=NH4Cl(aq)+H2O(l) △H=-akJ·mol-1
②HCl(aq) +NaOH( s)=NaCl(aq) +H2O(l) △H=-bkJ·mol-1
③HNO3(aq) +NaOH(aq)=NaNO3(aq) +H2O(l) △H=- ckJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较- 在量热计(如下图所示)中将l00cm3、0. 500mol·L-1 CH3COOH溶液与100cm3、0. 500mol·L-1 NaOH溶液混合,温度从298.16K升高到300. 71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150. 5J·K-1,CH3COONa溶液比热容为4.03J·g-1·K-1,溶液的密度为0. 963g·cm-3。

(1)试求CH3COOH的中和反应的反应热△H为____kJ·mol-1。
(2)CH3COOH的中和热的文献值为56. 1kJ·mol-1,请你分析(1)中测得的实验值偏差的可能原因是____。
(3)已知HCl( aq) +NaOH (aq)=NaCl(aq) +H2O(l) △H=- 57. 3kJ.mol-1;现有①CH3COOH、②浓H2SO4、
③HNO3与NaOH溶液反应的反应热分别为 △H1、△H2、△H3,则△H1、△H2、△H3三者的大小关系为___。 - 下列说法或表示方法正确的是 [ ]
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石) △H = +1.90 kJ/mol可知金刚石比石墨稳定
C.相同温度下,①pH=5的NH4Cl溶液、② pH=4的稀盐酸中由水电离出的c (H+):①<②
D.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+) > c(CH3COO-) - (1)稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。
① 实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式_________________;
② 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c= 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。则实验测得的中和热△H=_______(保留1位小数)
③ 如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”);理由是_____________________________;
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO。理论上每消耗标况下22.4 L NO就能放出290 kJ的热。写出该反应的热化学方程式
_____________________。 - 强酸和强碱稀溶液的中和热可表示为: H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1 已知:
CH3COOH( aq)+NaOH( aq) =CH3 COONa(aq)+ H2O(l) △H1
H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) △H2
HNO3( aq)+ KOH( aq)=KNO3(aq)+ H2O(l) △H3
上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是 [ ]
A.△H1=△H2=△H3
B.△H2>△H3>△H1
C.△H2<△H3< △H1
D.△H2=△H3<△H1 - H2SO4溶液和KOH溶液反应时有热量放出,并已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质:___。
(2)判断E1和E2的大小关系:E1____E2。
(3)已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列中和反应中放出的热量。
①用20g NaOH配成稀溶液跟足量的稀盐酸反应,能放出 ___kJ的热量。
②用0. 1mol Ba(OH)2配成稀溶液跟足量的稀硝酸反应,能放出___kJ的热量。 - 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是 [ ]
A.⊿H1>⊿H2>⊿H3
B.⊿H1<⊿H3<⊿H2
C.⊿H1<⊿H2<⊿H3
D.⊿H1>⊿H3>⊿H2 - 关于化学能与热能的叙述,正确的是 [ ]
A.1mol酸与碱恰好中和时所放出的热量叫中和热
B.化学反应中的能量变化,主要是由化学键变化引起的
C.需要加热才能发生的反应,一定是吸热反应
D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 - 已知:H+(aq) + OH-(aq) → H2O(l) + 57.3 kJ。对于下列反应:
①HCl(aq) + NH3 H2O(aq) → NH4Cl(aq) + H2O(l) + a kJ
H2O(aq) → NH4Cl(aq) + H2O(l) + a kJ
②HCl(aq) + NaOH(s) → NaCl(aq) + H2O(l) + b kJ
③HNO3(aq) + KOH(aq) → KNO3(aq) + H2O(l) + c kJ
则a、b、c三者的大小关系为 [ ]
A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较 - 已知:①H+(aq)+OH-(aq)==H2O(l);ΔH1;②2SO2(g)+O2(g)
 2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是[ ]
2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是[ ]
A.ΔH1增大,ΔH2减小
B.ΔH1增大,ΔH2增大
C.ΔH1减小,ΔH2减小
D.ΔH1不变,ΔH2不变 - 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应的△H1、△H2、△H3,关系正确的是[ ]
A.△H1>△H3>△H2
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3 - 下列关于中和热的说法不正确的是 [ ]
A.发生酸碱中和反应时所放出的热量叫中和热
B.中和反应的实质是H+ 与OH-结合生成水,若有其它物质生成,这部分反应热不在中和热内
C.在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热
D.中和热不包括物质溶解、电离、水合等过程中的热效应 - 中和反应是典型的放热反应,酸与碱发生中和反应生成1mol水时所释放的热量称为中和热。下列关于中和热的说法正确的是[ ]
A.中和反应生成盐和水的总能量高于酸和碱的总能量
B.稀盐酸和氢氧化钠固体反应生成1mol水释放的热量即为中和热
C.稀硫酸和氢氧化钡溶液反应生成1mol水释放的热量即为中和热
D.中和热的测定实验中应尽量防止反应中的热量损失 - 中和反应是典型的放热反应,酸与碱发生中和反应生成1mol水时所释放的热量称为中和热。下列关于中和热的说法正确的是[ ]
A.中和反应生成盐和水的总能量高于酸和碱的总能量。
B.稀盐酸和氢氧化钠固体反应生成1mol水释放的热量即为中和热。
C.稀硫酸和氢氧化钡溶液反应生成1mol水释放的热量即为中和热。
D.中和热的测定实验中应尽量防止反应中的热量损失。 - 下列说法或表示方法正确的是 [ ]
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由石墨比金刚石稳定可知:C(金刚石,s)===C(石墨,s) ΔH<0
D.在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol - 已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.4 kJ/mol 下列结论正确的是[ ]
A.炭的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀氢氧化钠溶液反应的中和热为-57.4 kJ/mol
D.稀醋酸与稀氢氧化钠溶液反应生成1 mol水,放出57.4 kJ热量 - 已知:H+(aq) + OH-(aq) = H2O(l) △H =-57.3 kJ·mol-1。对于下列反应:
①HCl(aq) + NH3·H2O(aq) = NH4Cl(aq) + H2O(l) △H =-a kJ·mol-1
②HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) △H =-b kJ·mol-1 则a、b的大小关系为 [ ]
A.a>b
B.b>a
C.a = b
D.无法比较 - 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
A.△H1>△H2>△H3 B.△H1<△H3<△H2 C.△H1=△H2=△H3 D.△H2<△H3<△H1 - 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O;△H=-57.3kJ/mol.分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系表示正确的是( )
A.△H2<△H3<△H1 B.△H1>△H2>△H3 C.△H1=△H2=△H3 D.△H2>△H3>△H1 - 下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 B.强酸跟强碱反应放出的热量一定是中和热 C.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s),△H<0 D.在101kPa、25°C时,1gH2完全燃烧生成气态水,放出120.9kJ热量,则氢气的燃烧热为241.8kJ/mol - 在用HCl和NaOH进行中和热测定实验中,若其他条件不变,用氨水代替NaOH,则会使测定结果△H( )
A.偏大 B.偏小 C.不变 D.无法判断 - 下列说法正确的是( )
A.酸与碱发生中和反应所放出的热量称为中和热 B.化学反应中能量变化的大小与反应物的质量多少无关 C.由1H、2H、3H、35Cl、37Cl组成的氯化氢分子有6种 D.O2与O3的相互转化是物理变化 - 下列中和反应中放出热量最多的是( )
A.100mL0.3mol/L的HCl和50mL0.3mol/L的NaOH相混合 B.80mL0.3mol/L的HCl和80mL0.3mol/L的NaOH溶液相混合 C.80mL0.3mol/L的H2SO4和80mL0.3mol/L的NaOH溶液相混合 D.50mL0.3mol/L的H2SO4和50mL0.6mol/L的NaOH溶液相混合 - 下列关于反应能量的说法正确的是( )
A.若反应A(s)=B(s),△H<O,则说明A物质比B物质稳定,分子内共价键键能A比B大 B.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量>生成物总能量 C.101kPa时,2H2(g)+O2(g)═2H2O(g);△H=-QkJ•mol-1,则H2的燃烧热为
QkJ•mol-l1 2 D.H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 - 下列过程都与热量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+
O2(g)═CO2(g);△H=-283.0kJ/mol1 2 B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
H2SO4(l)+KOH(l)═1 2
K2SO4(l)+H2O(l);△H=-57.3kJ/mol1 2 C.铝热反应是放热反应,但需要足够的热量才能使反应发生 D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 - 已知:①氯气、单质硫分别跟氢气反应的热化学方程式如下:
H2(g)+Cl2(g)=2HCl(g);△H1=-Q1 kJ/mol H2(g)+S(s)=H2S(g);△H2=-Q2kJ/mol②25℃,10l kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol 下列说法正确的是( )A.氢气的燃烧热为:QlkJ/mol B.Ql>Q2 C.氯气与硫化氢气体反应的热化学方程式:Cl2(g)+H2S(g)=2HCl(g)+S(s);△H2=-(Q2一Q1)kJ/mol D.KOH(aq)+HCl(g)=KCl(aq)+H2O(1);△H=-57.3kJ/mol - (1)已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量______kJ,由此测得的中和热为______kJ/mol.
(2)已知断开1molH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ. 计算H2和Br2反应生成1mol HBr需______(填“吸收”或“放出”)能量______kJ. - 已知:醋酸是弱酸,其电离过程的△H>0,而强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kI/mol,向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时的反应热△H1、△H2、△H3的关系正确的是( )最新试题
- 1美国建筑师设计出了一种能漂浮在水中的城市(如图所示),漂浮城市装有动力装置,可以移动。该漂浮城市三角形建筑的主体结构是中
- 2下列各句中,没有语病的一句是(3分)A.虽然经济有了发展,但脆弱的生态环境已经为我们敲响了警钟,让人类更好地适应自然,让
- 3非洲炎热气候形成的最主要原因是:A.海陆因素B.纬度因素C.洋流因素D.地形因素
- 4观察图A、B,回答下列问题: (1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可
- 5等差数列的前项和为,则
- 6《孔乙己》、《蒲柳人家》、《变色龙》、《热爱生命》这几篇小说,为我们讲述了生动的故事,塑造了栩栩如生的人物形象,请写出给
- 7已知:(a-b)2=4,ab=12,则(a+b)2=______.
- 8在(1-x)4-x3(1+3x)的展开式中,含x4项的系数为______.
- 92009年春,我国北方地区发生了严重的旱灾.(1)人工降雨是缓解旱情的重要手段,干冰等物质可用于人工降雨,撒在云层上的干
- 10下列句子中,没有语病的一项是( )A.北接陆上丝绸之路、南连上海丝绸之路,将于2014年申遗的“中国大运河”,包括了京
热门考点- 1假定英语课上老师要求同桌之间交换修改作文,请你修改你同桌的以下作文。文中共有10处语言错误,每句中最多有两处,每处错误仅
- 2将符合反应类型的反应的字母填在下列分类方法后的横线上: A.Fe3O4+4CO3Fe+4CO2 B.2KMnO4K2Mn
- 3男女两性生殖器官的差异称为第一性征。[ ]
- 4一根长直通电导线中的电流按正弦规律变化,如图所示,在直导线下方有一不闭合的金属框,则a、b两点电势差最大的时刻是( )
- 5解决有机分子结构问题的最佳手段是1H核磁共振。有机物分子中的氢原子在分子中的化学环境(原子之间相互作用)不同,在1H核磁
- 6 Planet Hunter When Geoff Marcy was 14, his parents bought h
- 7有关地球环境人口容量的说法,正确的是[ ]A、随着科技的发展,资源利用率提高,地球环境人口容量是无限的 B、环境
- 8The Board Meeting had come to an end. Bob started to stand u
- 9某课外兴趣小组为了解所在地区老年人的健康状况,分别作了四种不同的抽样调查.你认为抽样比较合理的是( )A.在公园调查了
- 10下列说法中,正确的是( )A.质点是一个理想化的模型,实际上是不存在的,所以引入这个概念没有多大意义B.当汽车驶过一座
版权所有 CopyRight © 2012-2019 超级试练试题库 All Rights Reserved.A.△H1>△H2>△H3 B.△H1<△H3<△H2 C.△H1<△H2<△H3 D.△H1>△H3>△H2 已知H++OH-=H2O生成1mol H2O放出热量57.3kJ,下列反应中放出57.3kJ热量的是( ) A.1mol稀H2SO4与足量NaOH溶液反应 B.稀盐酸与氨水反应生成1molH2O C.稀盐酸与稀Ba(OH)2溶液反应生成1mol水 D.稀NaOH与95%浓硫酸生成1mol水
