百科
气体的制备原理及发生装置
收集方法及装置
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。
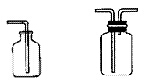
c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。
相关试题
已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似 性(提示:2Mg+CO2  2MgO+C).用如图所示的装置进行Mg和SO2的实验
2MgO+C).用如图所示的装置进行Mg和SO2的实验
(1)选择制取SO2的合适试剂________.
①10%的H2SO4溶液;②80%的H2SO4溶液; ③Na2SO3固体;④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:_______________________
(3)你认为该装置是否有不足之处?____________,如果有,请列出两点:
___________________________、____________________________分析下图装置,回答问题 
(1)装置A的烧瓶中发生的反应的化学方程式为____________________,
(2)装置C的直玻管中发生的反应的化学方程式为____________________,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是____________________,
(4)装置E中NaOH的作用是____________________,反应的离子方程式为____________________;
(5)B装置的作用很多,除了可以混匀气体外,还可以:____________________;__________________________________。二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/cm3,遇水易分解,以下是由氯气与硫反应合成二氯化硫的实验装置,其中F中装有无水CaCl2固体。 
试回答下列问题:
(1)装置A中发生反应的化学方程式为:_____________________________
(2)装置C中盛放的试剂是_______________ ,装置F的作用为________________________
(3)实验开始前先排尽系统中空气,此做法目的是 再向D中放入一定量的硫粉,加热使之融化,然后摇动烧瓶使硫附着在烧瓶内壁形成一薄层膜,这样做的目的是____________________________
(4)实验时,如何防止E中液体挥发____________________________
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置用下图中的装置进行实验,将A逐滴加入B中; 
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是_______(填化学式),B与浓H2SO4反应的化学方程式为__________________;反应后向烧杯中加入沸水, 又可观察到试管C中的现象为________________________。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中可观察到小试管内溶液变浑浊,则酸A应具有的性质是
_________________。然后向烧杯中加入沸水,可观察到试管C中的现象是_______________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后向烧杯中加入沸水,静置片刻,观察到试管壁出现光亮的银镜,则A是______(填名称),C是_______(填
化学式)与葡萄糖的混合液。该反应的离子方程式为_____________________________,仪器D在此实验中的作用是______________。研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O,制备SO2气体。①用下列简图,画出制各并收集SO2的实验装置(含试剂)示意图。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是_______________________ 。
(2)将SO2气体分别通入下列溶液中:①品红溶液,现象是__________________。②溴水溶液,现象是__________________。③硫化钠溶液,现象是__________________________。
(3)有一小组在实验中发现SO2产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满):
①原因______________,验证方法__________________________;
②原因______________,验证方法__________________________;
③原因______________,验证方法__________________________。用如下装置可以完成一系列实验(图中夹持装置已略去)。 
请回答下列问题:
Ⅰ若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
Ⅱ若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:
①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。
回答下列问题:
(1)p中盛装试剂为____________。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式________________。
①处包有的某固体物质可能是________。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到____________。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:____________________。用如下装置可以完成一系列实验(图中夹持装置已略去)。请回答下列问题:
Ⅰ若在装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体
(根据需要可以加热),并通过装置B完成表中所设计实验,请填写表中空白 (1) 
Ⅱ.若在装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做如下处理:
①包有某固体物质、 ②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。
回答下列问题:
(2)P中所盛试剂为________。
(3)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式_________________;①处包有的某固体物质可能是____
a.MnO2 b.KMnO4 c.KCl d.Cu
(4)在整个实验过程中,在③处能观察到的现象为____________
(5)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:_______________。用如下装置可以完成一系列实验(图中夹持装置已略去)。 
请回答下列问题:
(1)若在装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中所设计实验,请填写表中空白
若在装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做如下处理:
①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。
回答下列问题:
(2)p中所盛试剂为___________。
(3)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式__________________;①处包有的某固体物质可能是___________。
a.MnO2 b.KMnO4 c.KCl d.Cu
(4)在整个实验过程中,在③处能观察到的现象为__________________。
(5)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:_________________二氧化硫是硫的重要氧化物,具有特殊的性质。下面是某化学学习小组对二氧化硫性质的验证实验。
(1)实验用品:分液漏斗、_________(玻璃仪器名称)、试管、具支试管、玻璃导管、乳胶管;亚硫酸钠晶体、硫酸( 75%~90%)、NaOH稀溶液、NaOH浓溶液、酸性KMnO4溶液、Na2S稀溶液、酚酞试剂。
(2)实验装置
装置图中分液漏斗内的试剂是_________(写化学式)。
(3)实验步骤
①按照图示装置连接好实验仪器,检查装置气密性。检查方法是______________________。
②在具支试管Ⅱ、Ⅲ、Ⅳ中分别加入2 mL NaOH稀溶液(溶液中滴有酚酞试剂)、2 mL酸性KMnO4溶 液、2 mL Na2S稀溶液。其中Ⅱ中的实验现象是_____________;Ⅲ中现象说明SO2具有_________性;Ⅳ中若持续通入SO2,写出发生反应的化学方程式____________________。
(4)如果将具支试管Ⅲ内的酸性KMnO4溶液换为氯水,那么具支试管Ⅲ中发生反应的现象是_________,发生反应的离子方程式是______________________。
(5)试管V中加入的是NaOH浓溶液,其作用是__________。下图是实验室制备SO2并验证SO2某些性质的装置图。试回答 
(1)⑥中发生反应的化学方程式为_________________。
(2)⑤的作用是___________,反应的离子方程式为___________________。
(3)填表格
用下图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是 
[ ] 气体 a b c A. O2 双氧水 MnO2 浓硫酸 B. SO2 浓硫酸 Cu 酸性KMnO4溶液 C. NH3 浓氨水 生石灰 碱石灰 D. NO2 浓硝酸 铜片 NaOH溶液 下列在实验室使用常用玻璃仪器制取有关气体的反应原理正确的是 [ ] A. 2H2O2  2H2O+O2↑
2H2O+O2↑
B. Na2SO3 + H2SO4(稀)→Na2SO4 + H2O + SO2
C. NH4Cl(s) + NaOH(s) NaCl + H2O + NH3
NaCl + H2O + NH3
D. CaCO3 + H2SO4(稀)→CaSO4 +H2O +CO2↑下图是实验室制取SO2并验证SO2的某些性质的装置图。 
试回答:
(1)在⑥中发生的化学反应方程式为____。
(2)①中的实验现象为石蕊试液____,此实验证明SO2是___气体。
(3)②中的品红溶液____,证明SO2有___。
(4)③中的实验现象是____,证明SO2有____性。
(5)④中的实验现象是____,证明SO2有____性。
(6)⑤的作用是____,反应的化学方程式为___。哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题: 
⑴铜丝在实验中的作用:___________.
⑵实验过程中在装置C中会看到什么现象?__________请用化学方程式解释:___________。
⑶已知反应:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。
2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
⑷将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12 mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=_______________。若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡_____________(填“正向移动”、“逆向移动”、“不移动”、“无法确定”)。但若保持温度不变,只通入1.00 mol O2,则重新达到平衡时,SO2的平衡浓度_______。(填“填大”、“不变”或“减小”),O2的转化率_________(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”)。如下图是实验室制备SO2并验证SO2某些性质的装置图。试回答: 
(1)⑥中发生的化学反应方程式为____________________________。
(2)⑤的作用是________________________________,反应的离子方程式为 __________________________。
(3)填表格
下图中的实验装置可以用于实验室制取乙炔。请填空 
(1)图中A管的作用是____________,制取乙炔的化学反应方程式为____________。
(2)乙炔通入酸性KMnO4溶液中,发生____________反应,可以观察到____________现象,若通入溴水中,发生____________反应。
(3)乙炔燃烧的化学方程式为________________________,燃烧时的现象为____________,为了安全,点燃乙炔前应该先________________________。如下图的实验装置可用于实验室中制取乙炔。 
请回答下列问题:
(1)图中,A管的作用是______________ ,制取乙炔的化学方程式为_________________________ 。
(2)将制得的乙炔通入酸性KMnO4溶液中可观察到的现象是___________________ , 这是由于乙炔发生了_____________ 反应。
(3)将制得的乙炔通入足量的溴的四氯化碳溶液中,发生反应的化学方程式:_______。
(4)为了安全,乙炔气体在点燃前应______________ ,乙炔燃烧时的现象是___________________ 。图中的实验装置可用于制取乙炔。请填空: 
(1)图中,A管的作用是______________,制取乙炔的化学方程式是________________________________________________________________________。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是_________________________________________________________________________,乙炔发生了________反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是________________________________________________________________________,乙炔发生了________反应。
(4)为了安全,点燃乙炔前应________,乙炔燃烧时的实验现象是________________________________________________________________________。实验室用电石和水反应制备的乙炔气体中含有少量的H2S气体,为了净化和检验乙炔气体,并通过测定乙炔的体积计算电石的纯度,按下列要求填空(注意1X溶液为含溴3.2%的水溶液150 g)。 
(1)试从图中选用几种必要的装置,把它们连接成一套装置,这些被选用的装置的接口编号连接顺序是____________________________ 。
(2)写出制取乙炔的化学方程式:__________________________。
(3)为了得到比较平稳的乙炔气流,常用___________代替水,操作方法是_________________________。
(4)假设溴水与乙炔完全反应生成C2H2Br4。用W克的电石与水反应后,测得排入量筒内液体为VmL(标准状况)。则此电石的纯度计算式为_________________。(用含W、V的式子表示)下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 
[ ] A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L。现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题 
(1)CaC2和水反应的化学方程式是_______________________________。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是___________________________。
(3)本实验中测量气体体积时应注意的事项是_____________________________________。
(4)如果电石试样质量为c g,测得气体体积为d L,则电石试样中CaC2的质量分数计算式w(CaC2) =
__________。(杂质所生成的气体体积忽略不计)。下列获取物质的方法,不正确的是 [ ] A.用电石和饱和食盐水制取乙炔
B.通过石油分馏得到甲烷、乙烯和苯
C.用碳酸钠和氢氧化钙反应制氢氧化钠
D.将氯气通入氢氧化钠溶液得到漂白液实验室用如图装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空: 
(1)实验室制乙炔反应的化学方程式是__________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用__________来代替水。
(2)装置B中盛放有足量的NaOH溶液的作用是_________,反应的离子方程式是___________。
(3)装置C中观察到的现象是__________,反应的方程式是__________,该反应的类型是_________。
(4)装置D中观察到的现象是_________,该反应的类型是____________。乙炔是一种重要的化工原料,如图是制备乙炔及用乙炔生产其他物质的关系图。 
(1)由电石制乙炔的化学方程式为___。
(2)基态Ca2+的电子排布式为_____。
(3) CH三CH分子中,H-C键与C-C键间的夹角是__,其中心原子的杂化类型是____。
(4)氯乙烯(CH2=CHCl)是无色易液化气体,液化后的氯乙烯中,Cl原子与C原子之间的化学键类型是___,氯乙烯分子间的作用力是___ 。
(5)假设如图是电石(碳化钙)的晶胞,那么一个晶胞中含有___个钙原子,____个碳原子;该晶胞中存在一处错误,请指出:___。图中的实验装置可用于制取乙炔。请填空: 
(1)图中,A管的作用是______________,制取乙炔的化学方程式是____________________。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是__________________,乙炔发生了________反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是__________________,乙炔发生了________反应。
(4)为了安全,点燃乙炔前应________,乙炔燃烧时的实验现象是____________________。图中的实验装置可用于制取乙炔。请填空: 
(1)图中,A管的作用是______________,制取乙炔的化学方程式是____________________。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是__________________,乙炔发生了________反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是__________________,乙炔发生了________反应。
(4)为了安全,点燃乙炔前应________,乙炔燃烧时的实验现象是____________________。如图中的实验装置可用于制取乙炔。请填空 
如图中的实验装置可用于制取乙炔。请填空:
(1)图中A管的作用是 _____________,制取乙炔的化学方程式是 ________________。
(2)乙炔通入酸性KMnO4溶液中观察到的现象是________,乙炔发生的化学反应类型是 __________________。
(3)乙炔通入溴的CCl4溶液中观察到的现象是_____________________,乙炔发生的化学反应类型是_____________。
(4)为了安全,点燃乙炔前应____________,乙炔燃烧时的实验现象是________________。实验室用电石和水反应制取的乙炔气体中含有少量H2S 气体,为了净化和检验乙炔气体,并根据乙炔的体积计算电石的纯度,按下列要求填空(注意:X溶液为150 g含溴 3.2%的四氯化碳溶液)。
(1)试从如图所示装置中选用几种必要的装置,把它们连成一套装置,这些被选用的装置接口编号连接顺序是_________________。
(2)实验室能否用启普发生器制乙炔?其原因是_________________。
(3)为了得到比较平稳的乙炔气流,常可用__________代替水。
(4)假设溴水与乙炔完全反应,生成C2H2Br4,用W g的电石与水反应后,测得排入量筒内液体体积为V mL(标准状况下),则电石纯度计算式为_______________。以下均为中学化学实验中的常见实验装置,下列有关说法正确的是 
[ ] A.装置①,可用于分离沸点不同的两种液态有机物
B.装置②,可用于检验碳酸钠与碳酸氢钠两种固体
C.装置③,可用于实验室制取少量乙炔
D.装置④,选择合适药品时,可用于制取少量氨气或乙烯等如图装置可以用来制取某些气体。 
(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是____________(填化学式)。
(2)还能用该装置制备和收集的气体有(答出任意一种即可)_____________。
(3)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是___________,改进时还需要的玻璃仪器是____________;反应的化学方程式是 ________________ 。关于实验室制乙烯的实验,下列说法正确的是 [ ] A.反应物是乙醇和过量的3mol/L硫酸的混合液
B.温度计插入反应液液面以下,控制温度140°C
C.反应容器(烧瓶)中应加入少许瓷片
D.反应完毕先灭火再从水中取出导管在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。 
(1)I、II、III、IV装置可盛放的试剂是I_______;II_________;III_______;IV_______(将下列有关试剂的序号填入空格内); A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是____________________________;
(3)使用装置II的目的是____________________________;
(4)使用装置III的目的是____________________________;
(5)确定含有乙烯的现象是____________________________。实验室里浓硫酸与酒精的混合物在一定条件下可制得乙烯。请选用如下装置,验证所生成的乙烯中混有
CO2及SO2气体。
(1)实验室制乙烯时,浓硫酸与酒精按_________体积比混合,生成乙烯的化学方程式是___________________________。
(2)按气体流向从左→右,则各装置的接口次序是___________________________。
(3)能证明生成的乙烯中混有SO2气体的实验现象是:___________________________;
(4)能证明生成的乙烯中混有CO2气体的实验现是:___________________________。
(5)在制气装置中,最终反应混合物的颜色变成_________色。实验室制取乙烯的装置如下图所示,请根据图示回答下列问题 
(1)实验室制乙烯的化学方程式为____________________________ 在这个反应中,浓硫酸的作用是
_______________和___________________。
(2)某化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题
①I、II、Ⅲ、IV装置可盛放的试剂是I__________II__________Ⅲ__________IV__________ (填试剂的序号)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
②能说明SO2气体存在的现象是___________________________。
③确定含有乙烯的现象是_________________________下图为某实验小组的同学制备乙烯及验证乙烯性质的部分装置图,请回答 
(1)烧瓶中加入的两种试剂是__________________________;
(2)温度计的作用是_____________________,碎瓷片的作用是______________________;
(3)写出实验中产生乙烯的化学方程式:_______________________________;
(4)甲同学认为:溴水褪色的现象不能证明乙烯具有不饱和性,其原因是烧瓶中液体呈棕黑色而产生
__________气体。乙同学经过仔细观察后认为:试管中另一个现象可证明乙烯具有不饱和性,这个现象是_______________。丙同学为验证这一反应是加成而不是取代,提出了将杂质气体吸收后,可用pH试纸来测试反应后溶液的酸性,理由是____________________________________;
(5)处理上述实验中烧瓶内废液的正确操作是_______________。
A.废液直接倒入下水道
B.废液倒入空废液缸中
C.将水倒入烧瓶中
D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道(1)写出实验室制乙烯的化学方程式____________________________________
(2)该实验需加入碎瓷片目的是______________________________________
(3)下列实验操作正确的是___________A.配制乙醇与浓硫酸的混合液时,将1体积乙醇沿烧杯器壁缓缓注入3体积的浓硫酸中,并用玻璃棒不断搅拌
B.加热混合液时,应小心加热使温度缓缓上升至所需温度
C.温度计水银球的位置应伸入液面之下,而不是液面之上
D.收集乙烯气体时应用排水法收集,不能用排空气法收集
(4)在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
① I、II、III、IV装置可盛放的试剂是
I_________ ;II_________ ;III_________ ;IV__________(将下列有关试剂的序号填入空格内)。
A.NaOH溶液 B.酸性KMnO4溶液 C.溴水 D.品红溶液
②能说明SO2气体存在的现象是_______________________ 。
③确定含有乙烯的现象是_________________________ 。对于实验室制备乙烯的实验,下列说法正确的是 [ ] A.烧瓶中先加入反应药品,然后检查仪器的气密性
B.所用的反应药品为1体积酒精和3体积浓度为 5 mol/L的硫酸
C.收集乙烯可用排水法,也可用排空气法
D.温度计要插入反应液体的液面下,以控制温度在170℃实验室常用酒精和浓硫酸反应制取乙烯,试回答下列问题。
(1)酒精和浓硫酸的体积比是________,混合时,将________倒入________中,然后加入少量________,以免混合液加热时________。
(2)该反应的化学方程式是__________________________________________________,反应中,浓硫酸的作用是____________________________________________________。
(3)气体发生装置中,温度计的水银球应插入到________________________。
(4)实验时,要使混合液的温度迅速升高到170℃,这是因为____________________________。
(5)实验室通常用排水法而不用排空气法收集乙烯气体的原因是________________________________________________________________________。
(6)加热混合液逐渐变黑的原因是________________________________________________________________________,产生的气体有明显的刺激性气味,这是由于________________________________________________________________________。某化学兴趣小组用下图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。 
(1)写出该实验中生成乙烯的化学方程式:______________________________________。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是_________。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是________________________________________________________________________。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,
则A中的试剂应为_______________,其作用是_________________________________________________________________, B中的试剂为____________。
(5)处理上述实验后烧瓶中废液的正确方法是______。
A.废液冷却后倒入下水道中
B.废液冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸下列有关实验原理、装置、操作或结论的描述中,不正确的是(有关装置中的夹持仪器略去未画) [ ] A.制备少量氧气 
B.制取SO2、检验SO2的漂白性
C.分离Cl2与KI溶液反应生成的碘
D.实验室用乙醇和浓硫酸制乙烯
拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。 

(1)上述方法中可以得到干燥、纯净的气体是___________。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体___________,理由是______________________。
②气体___________,理由是______________________。
③气体___________,理由是______________________。
④气体___________,理由是______________________。实验室用下图所示装置制取乙烯。 
(1)①仪器A的名称________;②依器B中盛装的试剂是________。
(2)仪器B中盛装的试剂是________。
(3)装入药品前,应检查装置的气密性。检查该套装置气密性的操作是________________。
(4)若在导管口点燃乙稀,观察到的现象是________________。乙醇在浓硫酸作用下制取乙烯时,浓硫酸容易使乙醇碳化,用氧化铝替代浓硫酸重新设计实验如下。 
请回答:
(1)开始加热时应先点燃酒精灯_____(填“a”或“b”)。
(2)水的作用是______________,可以将该瓶中收集到的物质分离的常用方法是___________。(3)可利用  和乙烯合成世界上产量最大的合成纤维(PET), 其结构简式为:
和乙烯合成世界上产量最大的合成纤维(PET), 其结构简式为: 。
。
按下列示例写出 和乙烯合成PET的反应流程图(其他原料自选,并注明必要的反应条件)。反应流程图例如:
和乙烯合成PET的反应流程图(其他原料自选,并注明必要的反应条件)。反应流程图例如:
___________________________________________ 下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题 
(1)此装置用来制取乙烯,其中包括的仪器是:
①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程 100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞⑧双孔塞⑨导管。不选用的仪器有___________ (填其序号)
(2)写出实验室制取乙烯的化学方程式____。
(3)此处碱石灰的作用是.____。
(4)实验过程中,发现溴水会褪色,可能的原因是____。
(5)出现什么现象可说明生成了乙烷?____________ 。下图是实验室制取并检验乙烯性质的装置图,I试管装有溴水,II试管装有酸性高锰酸钾溶液。 
(1)写出生成烯的化学方程式____________________;
(2)浓硫酸的作用是____________;
(3)I试管中的现象有____________, 反应的化学方程式为____________;II试管中发生的反应属于
__________反应(填反应类型);
(4)实验的最后阶段,反应混合物的液体会变黑色,并有气体杂质生成,要除去这些杂质,应在洗气瓶中装入_________溶液; 若无此装置,I试管中还可能发生另外一个反应,该反应的离子方程式为________________________。
(5)验纯后,在导管末端点燃生成的气体,所观察到的现象是____________, 反应的化学方程式是________________________。实验室里用乙醇和浓硫酸反应制取乙烯,接着再用溴与之反应生成1,2-二溴乙烷。在制备过程中由于部分乙醇被浓硫酸氧化还会产生CO2、SO2,进而与Br2反应生成HBr等。
(1)用下列仪器,以上述三种物质为原料制备1,2 -二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡胶管均已略去):
经A(1)插入A中,______ 接A(2);A(3) 接_____接____接_______接________。
(2)在三颈烧瓶A中的主要反应的化学方程式为______________________;
(3)在反应管E中进行的主要反应的化学方程式为__________________;
(4)温度计水银球的正确位置是________________;
(5)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为____________________。已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难于得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PbO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。 
试回答有关问题:(1)装置的连接顺序是a、_______ 、_______ 、_______ 、_______ 、______ 、________ 、h(填各接口的字母)。
(2)写出A中所发生反应的化学方程式(有机物写结构简式):________________ 。
(3)D的作用是___________________。
(4)为减慢A中的反应速率,X应选用____________________。
(5)F中留下的气体除含少许空气外,还有_______________。G所选用的量筒的容积较合理的是_____。
A.500mL B.1000mL C.2000mL
(6)乙炔氢化的转化率为(用V来表示)_______________。最新试题- 1实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量
- 2物质的性质决定用途。请根据氢氧化钙、盐酸、水、铁四种物质的用途,进行填空:可用来降低土壤的酸性__________ ;可
- 3解方程:(x+1)2=3(x+1)
- 4将正奇数按一定规律填在5列的数表中,则第252行,第3列的数是__________. 13571513119 1719
- 5阅读理解 Lessons start at two o"clock in the afternoon. Ther
- 6一般人都是习惯于用右手写字,他们使用显微镜观察的正确做法为A.双眼睁开并注视镜筒B.双眼睁开,左眼注视镜筒C.左眼闭住,
- 7计算:
- 8美国经济学家曼昆在《比较优势的应用》一文中谈道,乔丹应该自己修剪草坪吗?答案显然是否定的。即使他灵活的身体可以比别人修得
- 9下列词语中加粗字的读音完全正确的一组是 [ ]
- 10His sister doesn"t like mutton _____ rice.[ ]A. or B.
热门考点- 1The country itself didn"t have enough gas because of the w
- 2下列各项中注音有误的一项是( )A.瓢泼piáo漂泊piāo漂流piāoB.妃嫔pín贻笑大方yí叱诧chìC.踌躇c
- 3(1)如图所示,重为2N的小球处于静止状态,画出它所受拉力的示意图.(2)如图所示,OB为反射光线,ON为法线.请画出入
- 4Tom thanked his sister helping him his lessons.A.for; wi
- 5第二节 完形填空(共20小题,每小题1.5分,共30分) 阅读下面短文,掌握其大意,从每题所给的A、B、C、D四个选
- 6以下物品所用材料中,属于有机合成材料的是( )A.不锈钢防盗门B.真丝围巾C.电脑塑料外壳D.玻璃茶杯
- 7下列叙述中,有关天气的是( )A.我国大部分地区降水集中在夏季B.昆明四季如春C.北京春季多风沙,秋季凉爽D.华北地区
- 8在草原上,人们为了保护牧草而大量捕***老鼠,这一举措将给草原造成的影响是 [ ]A.无明显的影响 B.生态平
- 9下列各句中,加点的成语使用恰当的一句是(3分)A.在庆祝香港回归祖国大型文艺晚会上,享有盛誉的香港歌手“四大天王”那极具
- 10下列说法中正确的是( )A.溶液是电中性的,胶体是带电的B.SiO2是将太阳能转化为电能的常用材料C.原电池中盐桥的作
版权所有 CopyRight © 2012-2019 超级试练试题库 All Rights Reserved.





