氧化还原、电化学的计算
氧化还原反应的计算
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如
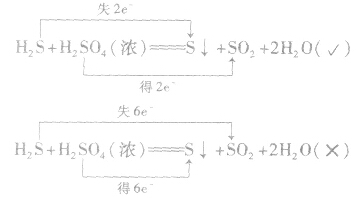
5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为: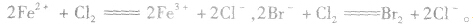
电化学计算
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式:
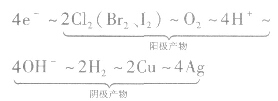
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用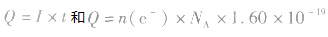 来计算电路中通过的电量。
来计算电路中通过的电量。
用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是 [ ]
A.相同状况下两电极上产生的气体体积之比为2∶1
B.两电极上产生的气体质量之比为8∶1
C.相同状况下两电极上产生的气体体积之比为4∶1
D.若两电极上产生的气体质量比为16∶3,则D2O与H2O的物质的量之比为1∶1用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为 [ ] A. 6mol
B. 7mol
C. 8mol
D. 9mol下图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g
9.55%的K2SO4溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
(1)电源的N端为_______________极
(2)电极b 上发生的电极反应为_____________________________
(3)列式计算电极b上生成的气体在标状况下的体积____________________
(4)电极c的质量变化是________________g用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为 [ ] A.6mol
B.7mol
C.8mol
D.9mol用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为 [ ] A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol由铜片、锌片和100mL稀硫酸溶液组成的原电池中,当铜片上产生2.24L(标态)气体时,硫酸恰好作用完,试计算:
(1)锌片质量减轻了多少克?
(2)原稀硫酸溶液的物质的量浓度是多少?在由铜片、锌片和200mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?
② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?
④ 若整个反应用时5分钟,则用H+表示该反应的平均速率为多少?氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g) ==2H2O(l) ΔH=-572kJ/mol 。 请回答下列问题
(1)生成物能量总和__________(填“>”、“<”或“=”)反应物能量总和。
(2)若1mol氢气完全燃烧生成水蒸气,则放出的热量_________(填“>”、“<”或“=”)286kJ。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造的一部分如图所示:a、b两个电极均由多孔的碳块组成。此装置的负极反应式为____________________,当正极消耗5.6L(标准状况)气体时,外电路转移的电子数为____________________。
在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,
H2SO4恰好用完。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。由碳棒、铁片和200mL稀H2SO4组成的原电池中,当在碳棒上共放出3.36L(标准状况)气体时,求消耗铁多少克?有多少个电子通过了电线? 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为 [ ]
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题 
(1)请写出B极板的名称:____________电极反应式________________________写出电解时反应的总离子方程式________________________
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。电解后溶液的pH为____________;要使电解后溶液恢复到电解前的状态,则需加入____________,其质量为____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)= 2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=____________甲、乙两个电解池均以铂为电极,且互相串联,甲池中盛有硝酸银溶液,乙池中盛有一定量的某盐溶液。通电一段时间后,测得甲池中电极质量增加2.16g,乙池中电极上析出金属0.24g,则乙池中溶质可能是 [ ] A.CuSO4
B.MgSO4
C.Al(NO3)3
D.Na2SO4以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100mol,则阴极上析出Cu的质量为 [ ] A.0.64g
B.1.28g
C.2.56g
D.5.12g通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是 [ ] A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
回答下列问题:
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是_____________________。
(2)这个电池负极的电极反应式为C8H18 + 25O2- →8CO2 + 9H2O +50e-,正极的电极反应式为
_____________________。固体电解质里O2-的移动方向是_________,向外电路释放电子的电极是_________。
(3)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了agM,则金属M的相对原子质量_________(用含“a、x”的表达式表示)。
②电解含有0.01mol CuSO4和0.01mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是
_________;将电解后的溶液加水稀释至1L,此时溶液的C(H+)=_________。海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时若配制1000mL0.20mol/LNaOH溶液,计算称量固体NaOH的质量。
(3)取初步净化处理的浓缩海水100mL,加入200mL0.20mol/LNaOH溶液,恰好把其中的Mg2+完全沉淀,求浓缩海水中Mg2+的物质的量浓度为多少。
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得标准状况下Cl2多少升?按图装置进行电解(均是惰性电极),已知A烧杯中装有500mL 20%的NaOH溶液,B烧杯中装有500mL
pH为6的1mol·L-1 CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)
[ ]
A.4
B.3
C.2
D.1用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为 [ ] A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol按下图装置进行实验,并回答下列问题 
(1)判断装置的名称:A池为___________ B池为___________
(2)铁极为__________极,电极反应式为________________________石墨棒C2附近发生的实验现象为
______________________________
(3)当C2极产生2.24L气体(标准状态)时,铁的质量变化(增加或减少)____了 ____g.CuSO4溶液的质量变化(增加或减少)____ 了____g如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度。 
用石墨作电极电解+n价金属的硝酸盐溶液,当阴极上析出mg金属时,阳极上产生560mL(标准状况)气体,此金属的相对原子质量应为 [ ] A.10n
B.10m
C.10mn
D.40mn将500ml PH=5的硫酸铜溶液用惰性电极电解一段时间后,溶液PH变为2(设电解前后溶液的体积不变)。若使溶液的浓度、PH与电解前相同,可以向电解后的溶液中加入 [ ] A.0.245g Cu(OH)2
B.0.31g CuCO3
C.0.0025mol H2SO4
D.0.2g CuO用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为 [ ] A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为 [ ] A.1 mol·L-1
B.2 mol·L-1
C.3 mol·L-1
D.4 mol·L-1在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、 NO3-、Cl-,该溶液放在用惰性材料做电极的电解槽中,通电片刻,则氧化产物和还原产物的质量之比 [ ] A.35.5:108
B.16:207
C.8:1
D.108:35.5用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.2mol Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移的电子为 [ ] A.0.4 mol
B.0.6 mol
C.0.2 mol
D.0.8 mol以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 
[ ] A.该电池能够在高温下工作
B.电池的负极反应为:
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体
将分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 [ ] A.1:2:3
B.3:2:1
C.6:3:1
D.6:3:2有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y值。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有气体产生,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是 [ ] A.27mg
B.54mg
C.108mg
D.216mg将1L含有0.4mol CuSO4和0.2mol NaCl的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1mol Cu,另一电极上析出气体(在标准状况下)的体积是多少?
(2)若在一个电极上恰好得到0.4mol Cu,另一电极上再析出气体(在标准状况下)的体积是多少?有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则:
(1)金属M的相对原子质量为____________;该硝酸盐晶体的化学式为____________;
(2)电解后溶液的pH=____________(电解过程中溶液体积变化忽略不计)。500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是 [ ] A.原混合溶液中c (K+)为4 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中c(H+)为2 mol·L-1将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 [ ] A.1∶2∶3
B.3∶2∶1
C.6∶3∶1
D.6∶3∶2已知铅蓄电池放电时发生如下反应:负极:Pb+SO42- -2e- =PbSO4,正极:PbO2 + 4H+ + SO42- + 2e- =
PbSO4 + 2H2O。实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是[ ] A.0.050mol
B.0.075mol
C.0.20mol
D.0.40mol将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤。取滤液,用铂电极电解一段时间。则分别在两极区析出的氧化产物与还原产物的质量比约为 [ ] A.35.5:108
B.108:35.5
C.8:1
D.1:2在1LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为 [ ] A.2.0 mol·L-1
B.1.5 mol·L-1
C.1.0 mol·L-1
D.0.5 mol·L-1用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为 [ ] A.1
B.3
C.7
D.11在25℃时,用石墨电极电解2.0L 2.5mol/L CuSO4溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:
(1)转移电子的物质的量,得到O2的体积(标准状况),溶液的pH?
(2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的pH是否变化? (相对原子质量 Cu:64)用惰性电极电解2L 1mol·L-1 CuSO4溶液,在电路通过0.5mol电子后,计算:
(1)阴极上析出金属质量。
(2)在阳极放出气体体积(标准状况)。
(3)溶液中H+物质的量浓度。以Fe为阳极,Pt为阴极,对足量的Na2SO4溶液进行电解,一段时间后得到4mol Fe(OH)3沉淀,此间共消耗水的物质的量为 [ ] A.6mol
B.8mol
C.10mol
D.12mol某冶炼厂以碳棒作电极,电解熔融状态的Al2O3,生成的氧气同时还与阳极碳棒反应生成CO和CO2,当生成54kg铝时,阳极消耗24kg碳,则阳极生成的CO和CO2中,CO和CO2的分子个数比为 [ ] A.1﹕2
B.2﹕1
C.1﹕3
D.1﹕1用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为 [ ] A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是 [ ]
A.相同状况下两电极上产生的气体体积之比为2∶1
B.两电极上产生的气体质量之比为8∶1
C.相同状况下两电极上产生的气体体积之比为4∶1
D.若两电极上产生的气体质量比为16∶3,则D2O与H2O的物质的量之比为1∶1如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。 
试求
(1)请写出①、②的电极反应式;
(2)通电前A池中原混合溶液Cu2+的浓度。在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为 [ ] A.1.62g
B.6.48g
C.3.24g
D.12.96g将0.3mol NaCl固体与0.1mol CuSO4·5H2O固体混合溶于水,配成1升混合液。然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解)。求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?所得溶液的PH为多少(假设溶液体积不变)? 有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量为242g/mol。取1.21g此晶体溶于水,配制成100mL溶液。将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01 mol电子通过电极时,溶液中全部金属离子恰好在阴极上析出,电极增重0.32g。
(1)1.21 g此盐晶体的物质的量是多少?x值是多少?
(2)求M的相对原子质量和n值。电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是 [ ] A.0.10 mol/L Ag+
B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+
D.0.20 mol/L Pb2+
- 1读非洲马达加斯加岛上某东西延伸的地质、地形剖面图,回答小题。小题1:古老基底地区先后经历的地质作用可能是A.外力侵蚀——
- 22012年3月5日,第十一届全国人民代表大会第五次会议在人民大会堂开幕。来自祖国各地的2900多名全国人大代表,肩负13
- 3如图所示实验基本操作错误的是[ ]A.B.C.D.
- 4写出下列句中加粗词的古义和今义。(1)率妻子邑人来此绝境古义:_______________今义:___________
- 5中国共产党的执政方式是什么?科学执政就是:按 办事,树立 观;民主
- 619世纪50年代,英国在华贸易下降的主要原因是( )A.中国开放的通商口岸太少B.英国享有的经济特权小C.英国的商品价格
- 7下图是我国2000年主要河流水质状况统计图,读图回答题小题1:从2000年我国主要河流水质状况看,所占比例最大的是A.Ⅴ
- 8“八七会议”前后,中共多次发动以夺取大城市为目标的武装起义,这表明中共A.尚未找到正确的革命道路B.还未认识到农民是革命
- 9(log52+log252)(log25+log85)=______.
- 10如图所示,光线斜射到两种透明物质的界面上发生的现象,那么图中界面是 ,法线 ,折射角是 。
- 1一个质量是10kg的物体,沿水平面做匀速直线运动,已知物体受到的摩擦力是20N,则物体受到的拉力是_____N;如果将该
- 2Harry’s father bought a magazine which gave its readers info
- 3学习化学能让我们更好的认识生活和世界,判断下列说法中正确的是( )A.天然物质都无毒无害B.可用工业酒精勾兑白酒C.食
- 4如图所示,两块相同的金属板M和N正对并水平放置,它们的正中央分别有小孔O和O′,两板距离为2L,两板间存在竖直向上的匀强
- 5我们常用的数是十进制的数,而计算机程序处理中使用的是只有数码0和1的二进制数.这两者可以相互换算,如:将二进制1101换
- 6用电子射线管演示带电粒子的磁场中受洛仑兹力的实验装置如图所示,图中虚线是带电粒子的运动轨迹,那么A接直流高压电源的
- 7在△ABC中,角A,B,C所对的边分别是a,b,c,tanA=,cosB=,若△ABC最长的边为1,则最短边的长为[
- 8(盐城市2009学年度高三第二次调研考试) 阅读下面的文字,根据要求作文。 雨果有句名言:“痛苦能够孕育灵魂和精神的力量
- 9有甲、乙两班学生,已知乙班比甲班少4人,如果从乙班调17人到甲班,那么甲班人数比乙班人数的3倍还多2人,求甲、乙两班原来
- 10要使一个菱形ABCD成为正方形,则需增加的条件是______.(填一个正确的条件即可)
