百科
溶液浓度计算
概念
一种可溶物质溶于一种溶剂后,在该溶剂的分布密度以百分比的方式表示,称为溶液百分比浓度(溶液质量分数),常用C%来表示(也可表示为w)
溶液质量分数与密度的关系
(1)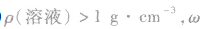 越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
(2)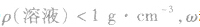 越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
溶液混合后质量分数的变化规律
质量分数分别为 的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
(1)等体积混合
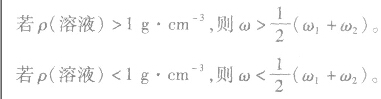
若是加等体积水稀释,可视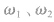 中其一为0 分析。
中其一为0 分析。
(2)等质量混合: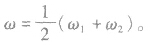
公式
溶液百分比浓度的计算公式为:
溶液的质量百分比浓度=溶质质量/溶液质量×100%
*其中 溶质质量+溶剂质量=溶液质量。
相关试题
将70克过氧化钠和氧化钠的混合物跟98克水充分反应后,收集到的气体体积在标准状况下为5.6L。
(1)试分别写出过氧化钠和氧化钠跟水反应的化学方程式。 ① ② 。
(2)计算原混合物中过氧化钠和氧化钠的物质的量之比,n(Na2O2):n(Na2O)= 。
(3)计算所得溶液的质量分数是多大?ω= 。密度为0.91g/mL的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液的质量分数 [ ]
A.等于12.5%
B.大于12.5%
C.小于12.5%
D.无法确定在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是 [ ] A.将20g硝酸钾饱和溶液蒸发掉10g水
B.将20g硝酸钾不饱和溶液蒸发掉10g水
C.在10g10﹪的硝酸钾溶液中,加入5g40﹪的硝酸钾溶液
D.将10g硝酸钾不饱和溶液中加入10g硝酸钾固体将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少? 主族元素R的最高价氧化物0. 112 g,溶于水制得100 g碱性溶液,其溶质的质量分数为0.148%,R原子核内含有20个中子。试通过计算,确定R元素在周期表中的位置。 工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为 [ ]
A. 70.0%
B. 69.5%
C. 63.6%
D. 53.8%将溶质A的质量分数为5X和X的两种溶液等体积混合,所得溶液中A的质量分数小于3X,则A可能是 [ ] ①H2SO4 ②C2H5OH ③NH3 ④CH3COOH ⑤NaOH
A、①⑤
B、①④⑤
C、②③
D、②③④已知35%NaOH溶液密度为1.38g·cm-3,5%的NaOH溶液的密度为1.05g·cm-3,若将上述两溶液等体积混合,所得NaOH溶液的质量分数为 [ ] A、>20%
B、=20%
C、<20%
D、无法估算密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为 [ ] A.等于13.5%
B.大于12.5%
C.小于12.5%
D.无法确定某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:
取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、 蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol·L-1的KMnO4 溶液滴定生成的H2C2O4溶液,共消耗12. 00mL
KMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+ 3H2SO4==10CO2↑+2MnSO4 +K2SO4 +8H2O。
问:该牛奶中钙的含量为多少mg/100mL?某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 [ ] A 30%
B
C 26.5%
D
某温度下,甲、乙两个烧杯中各盛有100g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为 [ ] A.10%
B.15%
C.20%
D.25%用密度为1.19g/cm3,质量分数为37%的浓盐酸配制稀盐酸:①用浓盐酸与等体积的水混合,所得稀盐酸的质量分数为a% ,②用浓盐酸与等质量的水混合,所得稀盐酸的质量分数为b% ,那么a与b的关系正确的是 [ ] A. a = b
B. a > b
C. a < b
D. 无法确定已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后二个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散) 
[ ] A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为了确保制备过程中既不补充水,也无多余水分,所用硝酸溶液溶质的质量分数应为 [ ] A.30%
B.63%
C.70%
D.无法确定已知25%氨水的密度为0.91 g·cm-3,5%的氨水密度为0.98 g·cm-3,若将上述两种溶液等体积混合,所得氨水溶液的质量分数 [ ] A.等于15%
B.大于15%
C.小于15%
D.无法估算已知14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将 [ ] A.大于40%
B.等于40%
C.小于40%
D.无法确定若以w1和w2分别表示浓度为amol·L-1和 bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) [ ] A.2w1=w2
B.2w2=w1
C.w2>2w1
D.w1<w2<2w1已知25%氨水的密度为0.91 g·cm-3,5%的氨水密度为0.98 g·cm-3,若将上述两种溶液等体积混合,所得氨水溶液的质量分数 [ ]
A.等于15%
B.大于15%
C.小于15%
D.无法估算已知硫酸溶液的质量分数越大时,其溶液的密度越大,将3x%与X%的两种硫酸溶液等体积混合后,溶液的质量分数 [ ]
A.大于2x%
B.小于2x%
C.等于2x%
D.无法确定密度为0.91g/mL的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液的质量分数 [ ]
A.等于12.5%
B.大于12.5%
C.小于12.5%
D.无法确定工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为 [ ]
A. 70.0%
B. 69.5%
C. 63.6%
D. 53.8%已知25%氨水的密度为0.91 g·cm-3,5%的氨水密度为0.98 g·cm-3,若将上述两种溶液等体积混合,所得氨水溶液的质量分数 [ ]
A.等于15%
B.大于15%
C.小于15%
D.无法估算某化工厂排放的废水中含氯总量以Cl2计为 0. 01 mol·L-1。该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除去Cl2并使溶液呈中性。试计算:
(1)所配固体试剂中NaOH的质量分数;
(2)若该厂每天排放废水100 m3,每天处理废水需该固体的质量(kg)。将10g NaCl和NaI的混合物溶于水后,通入足量的Cl2,将溶液蒸干灼烧得固体6.34g。求原混合物中NaCl的质量分数。 工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为了确保制备过程中既不补充水,也无多余水分,所用硝酸溶液溶质的质量分数应为 [ ] A.30%
B.63%
C.70%
D.无法确定工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为了确保制备过程中既不补充水,也无多余水分,所用硝酸溶液溶质的质量分数应为 [ ] A.30%
B.63%
C.70%
D.无法确定把70%HNO3溶液(密度为1.40g/cm3)加入等体积的水中,稀释后HNO3溶液中溶质的质量分数是 [ ] A、35%
B、小于35%
C、大于35%
D、小于或等于35%下图是医院病人输液使用的一瓶质量分数 5%的葡萄糖(C6H12O6)注射液的标签,请认真观察标签上所列内容后填写: 
(1)该溶液中含水_______g
(2)该溶液的密度约为__________g/mL。
(3)该溶液的物质的量浓度为_________mol/L已知25%氨水的密度为0.91g.cm-3,5%氨水的密度为0.98g-cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是( ) A.等于15% B.大于15% C.小于15% D.无法估算 某稀硫酸中溶质的质量分数为4.72%,密度为1.038g/cm3.计算该稀硫酸的pH值(结果取整数). 将4.6g金属钠投入到95.4g水中,所得溶液中溶质的质量分数为( ) A.等于4.6% B.等于8.0% C.小于8.0% D.大于8.0% 将浓度为18.4mol/L质量分数为98%的浓硫酸加水稀释至9.2mol/L,则稀释后溶质的质量分数为( ) A.大于49% B.小于 49% C.等于49% D.无法确定 常温下,已知氨水的密度随其浓度增大而减小.将10%的氨水和20%的氨水等体积混合,则混合后溶液中溶质的质量分数为
( )A.大于15% B.小于15% C.等于15% D.无法判断 某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g.若向此溶液中添加3.5g氯化钠和6.5g水,则所得溶液的溶质质量分数是( ) A.30% B.
×100%26.5+3.5 100+6.5 C.26.5% D.
×100%26.5+3.5 100+6.5+3.5 将质量分数为5%和15%的氨水分别进行等体积混合和等质量混合,所得溶液中溶质的质量分数分别为a和b(氨水密度小于1g/mL);将质量分数为5%和15%的硫酸分别等体积和等质量混合,所得溶液中溶质的质量分数分别为d和e,则a、b、d、e的大小关系正确的是( ) A.d>b=e>a B.a>b=e>d C.d>b>e>a D.a>e>b>d 在医学、日常生活中有下列常见的溶液:①福尔马林 ②医用消毒酒精 ③生理盐水 ④食醋,这些溶液中的溶质质量分数由大到小顺序为( ) A.①②③④ B.②①③④ C.②④①③ D.②①④③ 用密度为1.19g/cm3,质量分数为37%的浓盐酸配制稀盐酸:①用浓盐酸与等体积的水混合,所得稀盐酸的质量分数为a%,②用浓盐酸与等质量的水混合,所得稀盐酸的质量分数为b%,那么a与b的关系正确的是( ) A.a=b B.a>b C.a<b D.无法确定 已知质量分数为25%的氨水密度为0.91g/cm3,质量分数为5%的氨水密度为0.98g/cm3,若将上述两溶液等体积混合,所的氨水的质量分数为( ) A.等于15% B.大于15% C.小于15% D.无法估算 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后两个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)( ) A.溶质的物质的量浓度相同、溶质的质量分数不同 B.溶质的质量分数相同,溶质的物质的量浓度不同 C.溶质的物质的量浓度和溶质的质量分数都不同 D.溶质的物质的量浓度和溶质的质量分数都相同 
在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( ) A.将20g硝酸钾饱和溶液蒸发掉10g水 B.将20g硝酸钾不饱和溶液蒸发掉10g水 C..在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液 D.将10g硝酸钾不饱和溶液中加入10g硝酸钾固体 浓度不等的两种硫酸溶液等质量混合后,溶质的质量分数为a%,而等体积混合后,溶质的质量分数为b%;浓度不等的两种氨水等质量混合时,其溶质的质量分数为a%,而等体积混合后,溶质的质量分数为c%,那么a、b、c数值的关系是( ) A.a>b>c B.b>a>c C.c>b>a D.c>a>b
最新试题
- 1生活中经常对一些物理量进行估测,下列数值中最接近实际情况的是( )A.人骑自行车的平均速度约为1m/sB.中学生心脏正
- 2国家卫星海洋应用中心近日透露,2020年前,我国将发射8颗海洋系列卫星,加强对我国黄岩岛、钓鱼岛以及西沙、中沙和南沙群岛
- 3“朕惟祖宗肇造区宇,奄有四方,武功迭兴,文治多缺,五十余年于此矣。” “新朝立纲陈纪,当以国朝之成法,据唐宋之故典,参辽
- 4已知双曲线2x2-3y2-6=0的一条弦AB被直线y=kx平分,则弦AB所在直线的斜率是________________
- 5如果x2+6xy=16,y2-4xy=-12,那么x2+2xy+y2的值为______.
- 6阅读下面的文字,根据要求作文。(60分)礼物是有价的,情谊是无价的;鲜花是有价的,美是无价的;房子是有价的,家是无价的;
- 7设C1、C2、…、Cn、…是坐标平面上的一列圆,它们的圆心都在轴的正半轴上,且都与直线y=x相切,对每一个正整数n,圆C
- 8下列指定溶液中,各组离子可能大量共存的是A.pH=1的溶液中:K+、Fe2+、Cl-、NO3-B.在强酸溶液中:Na+、
- 9一个角的补角是它的余角的度数的3倍,则这个角的度数是多少?
- 10下列各组物质的性质由强到弱的顺序排列正确的是( )A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S
热门考点
- 1将方程-34x=12中未知数的系数化为1,得( )A.x=-83B.x=38C.x=23D.x=-23
- 2读我国某区域等高线(单位:米)地形图,读图完成问题。小题1:E点的海拔可能为A.142米B.192米C.98米D.298
- 3U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,
- 4在高利润的行业,市场上供求双方的关系应是A.供不应求B.供过于求C.供求平衡D.不能确定
- 5丹东市政府“为民办的15件实事”之一的“双万户”燃气改造工程正迅速推进.(1)已知燃气的热值为4×107J/m3,燃气的
- 6集合,,,则等于( )A.B.C.D.
- 7如图所示为“用DIS(位移传感器、数据采集器、计算机)研究加速度和质量的关系”的实验装置。小题1:小车上安装的是位移传感
- 8已知一块废弃的合金材料由金、铜两种金属组成,为了测定各成分的含量,技术人员将合金样品磨成粉末,取6.3 g该粉末在空气中
- 9将氯气通入溴化亚铁溶液后,再加入四氯化碳并振荡、静置。整个实验过程中肯定能观察到的现象是( )A.上层显黄棕色B.下层
- 10有CO与CO2的混合气体共33.6 L,其密度为1.726 g/L,已知混合气体共有9.03×1023个分子,则该混合气

 %
%  %
% %
%  %
%