百科
氨气
定义
氨气,Ammonia, NH3,无色气体。有强烈的刺激气味。密度 0.7710。相对密度0.5971(空气=1.00)。易被液化成无色的液体。在常温下加压即可使其液化(临界温度132.4℃,临界压力11.2兆帕,即112.2大气压)。沸点-33.5℃。也易被固化成雪状固体。熔点-77.75℃。溶于水、乙醇和乙醚。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸、铵盐和胺类等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜,人吸入过多,能引起肺肿胀,以至死亡 。
分子结构
氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。氨分子的空间结构是三角锥型,极性分子。
物理性质
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
化学性质
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有,
,氨的水溶液叫做氨水。在氨水中所含的微粒有,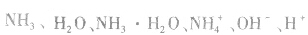 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
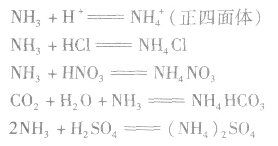
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键:
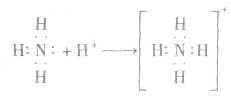
(3)具有还原性

(4)与CO2反应制尿素
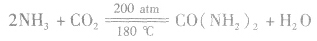
(5)配合反应

相关试题
下列说法中不正确的是 [ ] A.氨气极易溶于水,所以它是农业上常用的氮肥
B.工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定
C.大型中央空调的致冷剂可用液氨
D.铵盐易溶于水,且可与强碱发生复分解反应实验室里可用干燥纯净的氨气还原氧化铜来制取氮气。根据下列装置图回答有关问题: 
(1)装置(B)中盛放的药品是 。
(2)写出装置(A)中反应的化学方程式:____________________ 。
(3)写出装置(C)中反应的化学方程式:____________________ 。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有的气体是 ,确定是否含有该气体的实验方法是 。某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置。 
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并用单线桥标出电子转移的方向和数目。
(2)洗气瓶B的作用是 。C、E都是干燥装置,其中E中干燥管内所装的试剂是
(3)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分。请你协助他们完成该实验探究。
步骤①:取固体样品加少量水溶解,分装于两支试管中。向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,证明该固体中含有
步骤②:
(4)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见。
下列有关说法中正确的是 [ ] A.NH3与HCl气体或CO2气体均不能共存
B.铵盐溶液与NaOH 溶液混合后均会有NH3逸出
C.SiO2能溶解在NaOH 溶液但不能溶解在氨水中
D.硅、二氧化硅、硅酸、铵盐受热均很稳定为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题: 
(1)写出实验室制取氨气的化学方程式 。
(2)要得到干燥的氨气可选用 作干燥剂。
A、碱石灰(CaO和NaOH的混合物) B、浓硫酸 C、浓硝酸 D、氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是氨是一种重要的化工产品,其化学式为____________, 具有____________气味,密度比空气的_______(填“大”或“小”),________(填“易”或“难”)溶于水,因此,收集氨气应采用____________法。 下列关于氨气的说法正确的是 [ ]
A.氨既不能用浓硫酸干燥也不能用无水CaCl2干燥
B.氨水能导电,所以NH3是电解质
C.沸点:NH3<PH3<AsH3
D.用水吸收NH3用右图装置可防止倒吸:
以下物质间的转化通过一步反应都能实现的是 [ ] A.HCl→Cl2→HClO→NaClO
B.Si→SiO2→H2SiO3→Na2SiO3
C.S→SO3→H2SO4→Al2(SO4)3
D.NH3→NO2→HNO3→NaNO3考虑钠与水的反应,写出钠与液氨反应的化学方程式________________,其中氧化剂是____________。 下列说法中正确的是 [ ] A.NH3溶于水后,水溶液中存在大量NH4+
B.氨水中存在两种分子三种离子
C.氨气、氯气都极易溶于水,都可做喷泉实验
D.NH4HCO3受热分解产生的气体经碱石灰干燥后可得到纯净的氨气某温度下,在体积一定的密闭容器中适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl固体,则反应前后容器中的压强比接近于 [ ] A.1:11
B.11:1
C.7:11
D.11:7下列叙述不正确的是 [ ] ①NH3易液化,液氨常用作制冷剂
②与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
③氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
④稀HNO3和活泼金属反应时主要得到氢气
A.①③
B.②④
C.①②③④
D.都不正确下图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液,挤压胶管的胶头,下列与试验事实不相符的是 
[ ] A.CO2(NaHCO3溶液)无色喷泉
B.NH3(H2O含酚酞)红色喷泉
C.H2S(CuSO4溶液)黑色喷泉
D.HCl(AgNO3溶液)白色喷泉下列叙述不正确的是 [ ] A.NH3易液化,液氨常用作制冷剂
B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.稀HNO3和活泼金属反应时主要得到氢气Na3N是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:
(1)该化合物所形成的晶体是______________________
(2)写出Na3N与水反应的化学方程式________________________
(3)Na3N放入足量的盐酸中可以生成两种盐,其化学式分别为______________和______________。下列叙述正确的是 [ ] A.Li在氧气中燃烧主要生成 
B.将SO2通入溶液可生成 沉淀
沉淀
C.将CO2通入次氯酸钙溶液可生成次氯酸
D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu下列叙述不正确的是 [ ] A.NH3易液化,液氨常用作制冷剂
B.与金属反应时,稀HNO3可能被还原为更低价态,故稀HNO3氧化性强于浓HNO3
C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.浓硝酸和浓硫酸都可以储存于铝制槽罐中如图是课外活动小组的同学设计的4个喷泉实验方案。下列操作不可能引发喷泉现象的是 
[ ] A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由b口进气收集的气体有_____________(写序号);
(2)若烧瓶充满水,可收集的气体有_____________(写序号)。
(3)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有_____________, 这时气体由
_____________口进入。
取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体。实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色。请据以上实验事实分析:
(1)使湿润的红色石蕊试纸变蓝的气体是______________;
(2)写出NO3-发生反应的离子方程式,配平并填空。
①___Al + ___NO3-+ _______ + ___H2O → ___AlO2-+ _______
②氧化产物是____________
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的_________________ (填离子符号)对实验结果有干扰;
(4)工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,所得产物中还有氮气。若氮气和氨气的体积比为4:1,则除去0.1mol NO3-,消耗铝______ g。PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构________________
(2)请在以下空格内画出这两种固体分子的几何构型图
淡黄色固体:_________,黄绿色固体:_________
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式___________________________
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是___________________________某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答 
(1)实验前先将仪器按图连接好,然后________________,再开始实验。
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成_________色,盛无水CuSO4的干燥管内出现________色,并在最后的出气导管处收集到纯净。干燥的N2。根据这些现象,硬质试管中的反应方程式为________________,这个反应说明氨气其有_________性。
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是________________。
(4)洗气瓶中浓硫酸的主要作用是________________。
(5)在最后出气管口收集干燥.纯净的氮气,收集方法是_________(填编号)
A.排气法 B.排水法 C.用塑料袋或球胆收集。某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置。 
请回答下列问题
(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式
________________________
(2)洗气瓶B的作用是_______________。C、E都是干燥装置,其中E中干燥管内所装的试剂是________
(3)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分。请你协助他们完成该实验探究。
步骤①:取固体样品加少量水溶解,分装于两支试管中。向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,证明该固体中含有________________
步骤②:________________________
(4)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见。
________________________________若烧杯中盛水,能形成喷泉的气体可能是_____________(只填一种气体的分子式) 在图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大。则气体X与液体Y不可能是 
[ ] 气体X 液体Y
A.NH3 水
B.SO2 浓NaOH
C.CO2 稀H2SO4
D.HCl 水氯气是一种重要的工业原料。工业上利用反应  在检查氯气管道是否漏气。下列说法错误的是
在检查氯气管道是否漏气。下列说法错误的是[ ] A.若管道漏气遇氨就会产生白烟
B.该反应利用了 的强氧化性
的强氧化性
C.该反应属于复分解反应
D.生成 有
有 电子转移
电子转移 某兴趣小组用下图装置探究氨的催化氧化。 
(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为
32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为__________________。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式__________________。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式__________________。2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为___________________________ 。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式______________________________________________________ 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式_________________________________________ 。2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为_______________。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式_______________。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式_______________。下列反应说明氨气既有还原性,又有碱性的是 [ ] A.4NH3+5O2=4NO+6H2O
B.3Cl2+8NH3=N2+6NH4Cl
C.3CuO+2NH3=3Cu+ N2+3H2O
D.NH3+HNO3=NH4NO3写出下列反应方程式
(1)用过氧化氢制氧气的化学方程式_____________________
(2)铜与浓硫酸反应的化学方程式____________________
(3)硅与氢氧化钠溶液反应的化学方程式_____________________
(4)氨的催化氧化的化学方程式______________________
(5)NH4HCO3受热分解的化学方程式_________________________下列叙述正确的是 [ ] A.Li在氧气中燃烧主要生成Li2O2
B.将CO2通人次氯酸钙溶液可生成次氯酸
C.将SO2通入BaCl2溶液可生成BaSO3沉淀
D.将NH3通人热的CuSO4溶液中能使Cu2+还原成Cu下列实验过程中,始终无明显现象的是 [ ]
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba((NO3)2溶液中现有A、B、C、D、E五种元素,它们的原子序数依次增大且都小于18。A、E的最外层电子数相同,A元素的原子半径是所有元素中原子半径最小的。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物对应的水化物X与其氢化物Y反应生成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。
(1)写出X与Y反应生成盐的化学方程式:_________________。
(2)据中新网国家卫生部通报,截至2009年11月23日24 时,全国31个省(区、市)、新疆生产建设兵团累计完成甲型H1N1流感疫苗接种2118万支。为了避免甲型HIN1流感大面积爆发,部分公共场所、学校等人口密集地区经常使用主要成分为A2D2的消毒剂进行消毒。 A2D2被称为绿色消毒剂的理由是________, A2D2的电子式为_________。
(3)A、B、D、E四种元素组成的某无机盐受热易分解。写出少量该化合物与足量的Ba(OH)2溶液反应的离子方程式:________________。在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体呈喷泉状喷出,最终几乎充满烧瓶。符合上述现象的a和b的组合是 
[ ] a(干燥气体) b(液体) A. NO2 水 B. CO2 NaHCO3溶液 C. Cl2 饱和NaCl溶液 D. NH3 水 据内蒙古自治区赤峰市红山区人民政府2011年4月6日介绍,截至4月5日17时30分,赤峰制药集团氨气泄漏事故共有246名药厂工作人员、事故处理人员及周边群众到医院接受治疗。下列说法不正确的是 [ ] A.压缩机中的氨气是作为制冷剂
B.氨气泄漏时,消防队员可喷洒大量的水,减少氨气的扩散
C.氨气溶于水使其水溶液呈碱性
D.氨气溶于水的过程属于氮的固定二战结束后,希特勒集中营里幸存下来的200多名囚犯也重获自由。当地政府和名流特为他们开了庆贺宴。在他们大饱口福的几小时后,200多人竟无一例外地陆续死去,不知不觉、毫无痛苦。凶手不是他人,而是暴饮暴食导致的氨中毒。下列关于氨气的有关说法不正确的是 [ ] A.生石灰、无水氯化钙、浓硫酸、烧碱等都可用来干燥氨气
B.将氨气通入硝酸中可得NH4NO3,它是一种炸药,也可用于制作即用即冷的饮料。吸食前将饮料罐隔离层中的NH4NO3与水混合后摇动即会制冷
C.氨是一种很好的制冷剂是因为液氨在汽化时要吸收大量的热
D.若在同温同压下用等体积的烧瓶各收集满NH3和HCl做喷泉实验,若溶液均充满整个烧瓶,则两烧瓶内两溶液的物质的量浓度相等在研究合成氨方法及其催化作用的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药的原料。下列说法中正确的是 [ ] A.N2和H2在点燃或光照条件下可合成氨
B.氨和HNO3都是电解质
C.氨气遇到浓硝酸会发生反应产生白烟
D.由氨制取硝酸过程中,氮元素被还原化学家哈伯被人们称为既是“天使”又是“魔鬼”。他因在简陋的实验条件下攻克氨的合成这一世界难题,将无数人从饥饿的死亡线上拯救出来,受人尊敬并获得诺贝尔奖;他也因发明大量化学武器并用于战争,使无数人伤致死,遭人唾骂。某同学在实验室中发现了一瓶无色有刺激性气味的气体,根据气味判断可能是氨气,但不能确定一定是氨气。下列提供的方法中,你认为能够帮他检验是否为氨气的是 [ ] A.将湿润的红色石蕊试纸放在打开的瓶口
B.将湿润的蓝色石蕊试纸放在打开的瓶口
C.用蘸有浓硫酸的玻璃棒靠近打开的瓶口
D.用干燥的红色石蕊试纸放在打开的瓶口氨气中N元素呈最低价态(-3价),也具有很强的还原性,比如在加热条件下NH3也可还原氧化铜:2NH3+  ,在工业上也常利用反应3Cl2+2NH3 = N2+6HCl检查氯气管道是否有轻微的漏气。下列有关此说法错误的是
,在工业上也常利用反应3Cl2+2NH3 = N2+6HCl检查氯气管道是否有轻微的漏气。下列有关此说法错误的是 [ ] A.若管道漏气遇氨就会产生白烟
B.该反应利用了氯气的强氧化性
C.该反应属于复分解反应
D.生成l mol N2有 6mol电子转移最新试题- 1下列国家,盛产热带经济作物的是 [ ]A.巴西B.日本C.英国D.俄罗斯
- 2下面是某同学通过一年的化学学习,对所学化学知识进行归纳的情况.(1)对环境污染及治理方法连线正确的是______.A.减
- 3根据图片内容写出正确的短语。1. 2. 3. 4. 5.1. I __________
- 4代数式﹣2x,0,3x﹣y,,中,单项式的个数有[ ]A.1个B.2个C.3个D.4个
- 5有的幼儿吃了很多钙片,但仍患佝偻病,主要原因是缺乏( )A.维生素BB.维生素DC.维生素AD.维生素C
- 6下列各句中,没有语病的一句是( )A.鸦片战争以来的中国近代史,对于大多数中学生是比较熟悉的,重大的历史事件都能说
- 7如图所示,在磁感应强度大小为B、方向竖直向下的匀强磁场中,垂直于磁场方向放置长度为L的通电导体MN,若导体中的电流大小为
- 8证明(sinα-cosα)2+sin2α=1.
- 9下图表示人体骨髓造血干细胞的生命历程。请据图回答:(1)区分①细胞与植物细胞最主要的依据是_______,细胞②不能无限
- 10【题文】下列词语中,没有错别字的一项是( )A.附和 熨帖 改弦更章 委曲求全B.脉搏 涵盖 计日成功 锱铢必较C.折中
热门考点- 1如图所示是我国110m栏优秀运动员刘翔在比赛途中及冲过终点时的两个镜头.图1比赛途中,观众认为刘翔跑的最快的判断方法是_
- 2下列不属于中东地区的焦点问题的是( )A.丰富的石油资源B.东西交通要道C.匮乏的水资源D.主要是白色人种
- 3室温下,a克硝酸钠溶解于b克水中,溶液恰好达到饱和.则该温度下,硝酸钠的溶解度为______克.
- 4Jenny!Do you know that one-third of the boys in our class __
- 51910年,对23个主要城市金融机构的调查结果表明:工商企业贷款平均年利率近15%,广州更高达36%,远高于同时期欧美国
- 6下列关于阿司匹林()的说法正确的是[ ]A.阿司匹林属于羧酸类有机物 B.阿司匹
- 7当乙醇(C2H5OH)在人体血液中的含量超过80mg/100mL(每100mL血中含有80mg乙醇)时会影响人的驾车能力
- 8下列有关秦朝修筑长城的表述,不正确的是 A.目的是为了
- 9为了避免漫画中小男孩的情况出现在我们身上,我们应该[ ]①树立正确的考试观念,把考试视为检验学习成果的一次机会②
- 10某多边形的内角和与外角和相等,这个多边形的边数是______.
版权所有 CopyRight © 2012-2019 超级试练试题库 All Rights Reserved.



