百科
硫酸
概念
硫酸的分子式:H2SO4;结构式: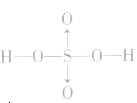 ,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
特性
(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。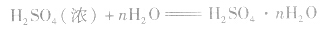 。
。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物: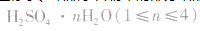 。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有、
。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有、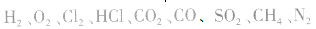 等酸性或中性气体,而具有还原性的气体
等酸性或中性气体,而具有还原性的气体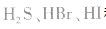 和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如
和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如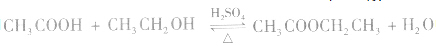 中,浓H2SO4作催化剂和吸水剂。
中,浓H2SO4作催化剂和吸水剂。
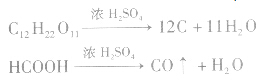
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如:
(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。但热的浓 H2SO4能氧化大多数金属(除金、铂外)、某些非金属单质及一些还原性化合物。如:
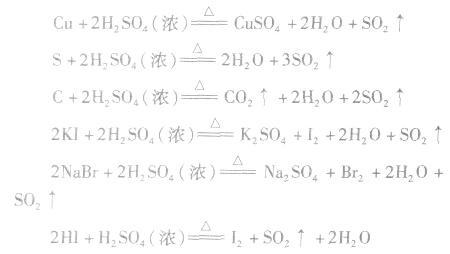
在这些氧化还原反应中,浓硫酸的还原产物一般为SO2。
相关试题
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后再加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体。
请回答:
(1)生成的黑色物质是_____________(填化学式)。
(2)刺激性气味的气体主要成分是______(填化学式),产生该气体的化学方程式为______________。
(3)根据上述实验现象,表明浓硫酸具有_______________(填序号)。
① 酸性 ② 吸水性 ③ 脱水性 ④ 强氧化性在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)变黑后,黑色物质会继续与浓硫酸作用产生两种气体,这种黑色物质与浓硫酸作用的化学方程式为
_______________________________
(2)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 ______________(填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性下列叙述或操作正确的是 [ ] A.浓硫酸具有强氧化性,稀硫酸无氧化性
B.稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌
C.浓硫酸不慎沾到皮肤上,应立即用布拭去,再用水冲洗
D.浓硫酸与铜的反应中,浓硫酸只表现强氧化性镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。关于反应中镁和铝的说法正确的是 
[ ] A.质量之比为3:2
B.物质的量之比为4:3
C.摩尔质量之比为2:3
D.消耗硫酸的物质的量之比为1:1对下列事实的解释,错误的是 [ ] A.稀H2SO4能与Fe反应产生H2,说明稀H2SO4也有氧化性
B.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性
C.浓H2SO4能使胆矾由蓝变白,说明浓H2SO4具有吸水性
D.常温下,浓H2SO4可以用铝(或铁)容器贮存,说明浓H2SO4与Al(或Fe)常温下不反应浓硫酸能使纸片变黑,是由于它具有_________性;浓硫酸可以与木炭反应,是由于它具有__________性,反应的方程式为______________________。 对于硫酸和硝酸的比较中,下列叙述不正确的是 [ ] A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.浓硫酸和浓硝酸都具有强氧化性
D.硫酸和硝酸都是重要的化工原料下列关于浓硫酸的说法不正确的是 [ ] A.常温下浓硫酸可以用铝制容器盛放
B.室温下浓硫酸与铜片会发生剧烈的化学反应
C.浓硫酸与灼热的木炭反应生成二氧化硫、水和二氧化碳
D.浓硫酸有吸水性常用作干燥剂下列说法中,错误的是 [ ] A.冷的浓硫酸可以用铁制或铝制的容器贮存
B.浓硫酸能作为H2的干燥剂,是因为浓硫酸有吸水性
C.把木屑放入浓硫酸中时,木屑变黑,是因为浓硫酸有脱水性
D.稀硫酸中的H2SO4在所有的化学反应中都不能作氧化剂写出下列化学反应的化学方程式或离子方程式。
(1)加热条件下,木炭与浓硫酸反应(化学方程式):_______________________
(2)氧化铝溶于氢氧化钠溶液中(离子方程式):_______________________
(3)氢氧化铝溶于氢氧化钠溶液中(离子方程式):_______________________
(4)制造普通玻璃时,纯碱与石英在高温下的反应(化学方程式):_______________________
(5)在加热至一定温度和有催化剂的条件下,SO2与O2反应(可逆反应,化学方程式):
_______________________进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 [ ] A.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
B.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成能溶于浓硝酸
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含硫酸根离子
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化下列有关试剂的保存方法及性质描述错误的是 [ ] A.浓硝酸保存在无色玻璃试剂瓶中
B.氢氧化钠溶液保存在有橡皮塞的玻璃试剂瓶中
C.在蔗糖中滴加浓硫酸,蔗糖变黑是因为浓硫酸具有脱水性
D.常温下浓硫酸可以用铝罐储存,是因为铝能在冷的浓硫酸中钝化某非金属单质A经如下图所示的过程转化为含氧酸D,已知D为强酸,请回答: 
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①写出A的原子结构示意图:________________
②把B通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀化学式为:
_______________________
③D的浓溶液在加热的条件下可与Cu反应,该反应的化学方程式为:______________
(2)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式______________。
②C→D的反应中氧化剂与还原剂物质的量之比为:______________
③写出A与H2反应产物的结构式:______________下列关于浓硫酸的叙述正确的是 [ ] A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸在常温下能够使铁、铝钝化
D.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体有甲.乙两个装置(见下图),先在胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,会观察到两装置中的气球都会慢慢地胀大(忽略液体体积对气球的影响)。甲.乙装置中所用的试剂不可能是 
[ ] A.甲:浓硫酸和木炭 乙:NaOH溶液和氨气
B.甲:浓氨水和碱石灰 乙:NaOH溶液和SO2
C.甲:稀硫酸和Na2CO3溶液 乙:稀硫酸和氨气
D.甲:浓硫酸和浓盐酸 乙:蒸馏水和氨气下图是某硫酸试剂瓶的标签上的部分文字。据此,下列说法正确的是 
[ ] A.向50mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46mol
B.1mol Zn与足量的该硫酸反应生成2g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol·L-1
D.该试剂应保存在玻璃试剂瓶中,并用橡胶塞紧对下列实验现象的描述,不正确的是 [ ] A.铁丝在氯气中燃烧产生棕黄色的烟
B.蘸有浓硫酸的玻璃棒伸到集满氨气的瓶中会产生白烟
C.表面有黑色氧化铜的热铜丝遇酒精蒸汽又会变成红色的铜
D.在纯氧中点燃铝箔会产生耀眼的白光下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是 [ ] A.在空气中敞口久置的浓硫酸,溶液质量增大(挥发性)
B.在加热条件下铜与浓硫酸反应(脱水性)
C.浓硫酸在白纸上书写的字迹变黑(氧化性)
D.浓硫酸可用来干燥某些气体(吸水性)下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是 [ ] A.在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性)
B.在加热条件下铜与浓硫酸反应(强氧化性、酸性)
C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(脱水性)下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是 
[ ] ①食盐水 ②KNO3溶液 ③适量稀盐酸 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水 ⑦苯
A.①③⑤
B.②⑥
C.①②③⑤⑦
D.①②④常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入
Ba(OH)2溶液的体积关系如图所示,下列说法中正确的
[ ] A.b处溶液的c(H+)与d处溶液的c(OH-)相等
B.a~d溶液的导电能力:a<b<c<d
C.a~d溶液的C(H+):a>b>c>d
D.c处溶液和d处溶液均呈碱性下列叙述中不正确的是 [ ] A.铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸
B.久置的浓硝酸呈黄色
C.硝酸电离出 的能被Zn、Fe等金属还原成
的能被Zn、Fe等金属还原成
D.浓硫酸是一种干燥剂,能够干燥 、氧气等气体
、氧气等气体 下列推断合理的是 [ ] A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 
[ ] A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色实验室用简易装置制氢气时,若在加稀硫酸时,发现锌粒与酸没有接触而稀硫酸又不够,为使反应顺利进行,则可以从长颈漏斗中加入的试剂是 [ ] ①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤
B.②⑥
C.③⑤
D.①②④某学生配制浓硫酸和浓硝酸的混合液,将浓硫酸较快地加入到浓硝酸中时,在容器口产生大量的白雾。 与解释这一现象无关的叙述是 [ ] A.浓硫酸和水作用放出大量的热
B.硝酸具有挥发性
C.硝酸蒸气易溶于空气中水蒸气
D.浓硫酸有强氧化性某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液分别是 
[ ] 纸蝴蝶上的喷洒液 小烧坏中的溶液
A. 酚酞 浓盐酸
B. 酚酞 浓氨水
C. 石蕊 氢氧化钠溶液
D. 石蕊 浓硫酸下表中有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液) 
根据该表回答问题:
(1)第Ⅲ组中有一种物质能与第__________组中的所有物质反应,这种物质是____________。
(2)不跟第1组所有物质发生反应是第Ⅱ组物质中的______________,且该物质能与第Ⅲ组中所有物质发生反应,其化学方程式分别为____________________,____________________,____________________。“亲爱的水:每当我遇上你,我就有种沸腾的感觉。当我见不到你时,我甚至会在空气中寻找你的气息……’----这是浓硫酸对水的真情告白。图中小试管中盛有几毫升水,与大试管连通的U形细玻璃管内放有少量水(已染成红色)。如沿小试管壁小心地慢慢注入3 mL浓硫酸,静置片刻后,U形细玻璃管中可观察到的液面现象是 
[ ] A.左高右低
B.左低右高
C.左右一样高
D.来回振动98%的浓硫酸和2 mol/L的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如图所示。a、b 曲线变化的原因是 
[ ] A.a挥发,b吸水
B.a升华,b冷凝
C.a蒸发,b潮解
D.a冷凝,b吸水下列关于浓硫酸的叙述中,正确的是 [ ] A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出SO2气体
C.浓硫酸是一种干燥剂,能干燥NH3、H2等气体
D.浓硫酸在常温下能使铁、铝等金属形成氧化膜而钝化在下图的实验装置中,从实验开始到过一段时间后,对观察到的现象叙述不正确的是 
[ ] A.①中苹果块会干瘪
B.②中胆矾晶体表面有“白斑”
C.③中小试管内有晶体析出
D.④中pH试纸变红图中是某校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是 
[ ] A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2g氢气
C.配制200 mL 4.6mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液浓度大于9.2mol/L硫酸厂有一辆存放过浓硫酸的铁槽车。某新工人违反操作规程,边吸烟边用水冲洗,结果发生了爆炸事故。下列对引起爆炸的原因分析正确的是 [ ] A.浓硫酸遇明火爆炸
B.浓硫酸遇水发热,爆炸
C.铁与水反应产生氢气,接触空气,遇明火爆炸
D.稀释后的硫酸与铁反应,产生的氢气接触空气,遇明火爆炸实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是 
[ ] ①装有铜片的孔穴中溶液呈蓝色 ②装有胆矾的孔穴中固体的颜色变浅 ③装有铁片的孔穴中溶液呈浅绿色 ④装有铁片的孔穴中溶液呈浅黄色 ⑤装有铜片的孔穴中产生红棕色气体
A.①④
B.②③
C.①⑤
D.②⑤等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积(同温同压)与反应时间的关系如图所示,则下列说法正确的是 
[ ] A.三种金属的活动性大小可能为甲>乙>丙
B.反应时消耗硫酸的质量一定相同
C.三种金属的相对原子质量是甲>乙>丙
D.反应速率最快的是甲,最慢的是乙对于硫酸和硝酸的比较中,不正确的是 [ ] A. 冷的浓硫酸和浓硝酸都可以用铝、铁投制容器盛装
B. 稀硫酸和稀硝酸都具有氧化性
C. 硫酸和硝酸都是重要的化工原料
D. 浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性下列推断合理的是 [ ] A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水色后加热也能恢复原色有甲、乙、丙三瓶等体积、等物质的量浓度的硫酸。若将甲用水稀释,乙中加入适量的BaCl2溶液,丙不变,然后用等浓度的NaOH溶液中和,至完全反应时,所需NaOH溶液的体积是 [ ] A.丙>乙>甲
B.甲=丙>乙
C.乙>丙>甲
D.甲=乙=丙
最新试题
- 1-- is he?--He is PSY. He sang the song Gangnam St
- 2函数f(x)=cosx(sinx+cosx)(x∈R)的最小正周期是______.
- 3【题文】已知集合,若,则实数的取值范围是______________.
- 4It was global warming , rather than other causes , ______ le
- 5两位同学在水平路面上推动底部垫有圆木的木箱做匀速直线运动如图,其中在木箱下垫上圆木是为了__________,木箱受到推
- 6【题文】 依次填入下面一段文字横线处的语句,衔接最恰当的一组是数学作为文化的一部分,其最根本的特征是它表达了一种探索精神
- 7读“北半球部分地区某月海平面及地面等压线分布图”,回答下列问题。(1)图中A处的气压中心名称是_____________
- 8(12分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分
- 92名医生和4名护士被分配到2所学校为学生体检,每校分配1名医生和2名护士,不同的分配方法共有______种.
- 10给出下列判断:①在数轴上,原点两旁的两个点所表示的数都是互为相反数; ②任何正数必定大于它的倒数;③5ab ,,都是整
热门考点
- 1如图,在梯形ABCD中,AD∥BC,BD=CD,AB<CD且∠ABC为锐角,若AD=4,BC=12,E为BC上一点,问:
- 2下列关于卤族元素的递变规律不正确的是A.F2、Cl2、Br2、I2的氧化性逐渐减弱B.HF、HCl、HBr、HI的热稳定
- 3对光时如果视野较暗,应选择下列哪项来进行调节①较大的光圈 ②较小的光圈 ③反光镜的平面 ④反光镜的凹面 [ ]
- 4一个正五边形与一个正方形的边长正好相等,在它们相接的地方,形成一个完整的“苹果”图案(如图).如果让正方形沿着正五边形的
- 5下列血管中,流着动脉血的是( )A.肺静脉B.肺动脉C.上腔静脉D.下腔静脉
- 6下列各项表示动物与其栖息环境之间的对应关系,其中正确的是( )A.丹顶鹤——湿地B.袋鼠——森林C.金丝猴——草原D.
- 7读太阳直射点回归运动示意图,回答问题:(10分)(1)写出上图中A、B、C、D代表的节气名称和大致日期:A——
- 8某药厂准备生产一种口服液,瓶盖为橡皮塞,为了方便患者服用,应该选用如图所示的哪种吸管,为什么?
- 9(2011?金华)在中国旅游日(5月19日),我市旅游部门对2011年第一季度游客在金华的旅游时间作抽样调查,统计如下:
- 101998年某人的年龄恰等于他出生的公元年数的数字之和,那么他的年龄是______岁.


