硝酸
定义
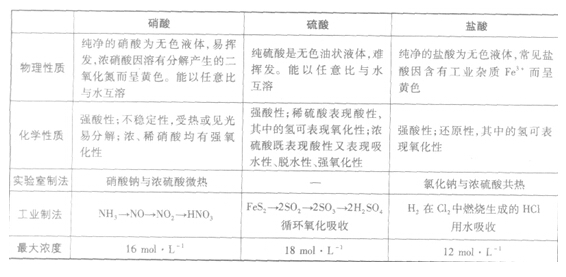
硝酸是一种强氧化性、腐蚀性的强酸。硝酸易溶于水,常温下其溶液无色透明。其不同浓度水溶液性质有别,市售浓硝酸为恒沸混合物,质量分数为69.2%(约16mol/L),质量分数足够大(市售浓度为95%以上)的,称为发烟硝酸。硝酸易见光分解,应在棕色瓶中于阴暗处避光保存,也可保存在磨砂外层塑料瓶中(不太建议),严禁与还原剂接触。硝酸在工业上主要以氨氧化法生产,用以制造化肥、炸药、硝酸盐等;在有机化学中,浓硝酸与浓硫酸的混合液是重要的硝化试剂。化学式是HNO3,浓硝酸与浓盐酸按体积比1:3混合可以制成具有强腐蚀性的王水。硝酸的酸酐是五氧化二氮(N2O5)。
三大强酸
物理性质
纯硝酸为无色透明液体,浓硝酸为淡黄色液体(溶有二氧化氮),正常情况下为无色透明液体。有窒息性刺激气味。浓硝酸含量为68%左右,易挥发,在空气中产生白雾,是硝酸蒸汽与水蒸汽结合而形成的硝酸小液滴。露光能产生二氧化氮而变成棕色。有强酸性。能使羊毛织物和动物组织变成嫩黄色。能与乙醇、松节油、碳和其他有机物猛烈反应。能与水混溶。能与水形成共沸混合物。相对密度(d204)1.41,熔点-42℃(无水) ,沸点120.5℃(68%)。对于稀硝酸, 一般我们认为浓稀之间的界线是6mol/L,市售普通试剂级硝酸浓度约为68%左右,而工业级浓硝酸浓度则为98%,通常发烟硝酸浓度约为98%。
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、
Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
(1)甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中,且石蕊试液不变色;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素且显+3价。请写出NaNO3受热分解的化学方程式:________________________;
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式:________________________,实验过程中还应看到的现象为________________________。
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑, (Ⅱ) 2AgNO3
2Ag2O+4NO2↑+O2↑, (Ⅱ) 2AgNO3 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
请你分析,可能正确的是哪一个并说明理由:________________________。
请你设计一个简单的实验证明你的结论是正确的:________________________;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与______________有关。下列物质的俗名与化学式不相符的一组是 [ ] 化学式 俗名 A. Na2SiO3 水玻璃 B. CaSO4·2H2O 石膏 C. NaNO3·10H2O 芒硝 D. CaCO3 石灰石 在下列反应中,HNO3既表现出氧化性,又表现出酸性的是 [ ]
A.H2S+2HNO3=S↓+2NO2↑+2H2O
B.CuO+2HNO3=Cu(NO3)2+H2O
C.4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D.3Cu +8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 [ ] A.KI淀粉溶液中通入Cl2,溶液变蓝---Cl2能与淀粉发生显色反应
B.浓HNO3在光照条件下变黄---浓HNO3不稳定,生成有色产物能溶于浓硝酸
C.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成---说明该溶液中含有SO42-
D.铜片放入浓硫酸中,无明显变化---说明铜在冷的浓硫酸中发生钝化将加热至红热的2.4g木炭投入盛有足量12mol·L-1的浓HNO3的试管中,立即塞好塞子,如图所示,连接好(事先已检查装置的气密性)。请回答 
(1)反应开始后撤去酒精灯,试管a中除看到木炭剧烈燃烧,最后消失外,还观察到的现象是_______________________________;
(2)试管中b最终______沉淀产生(填“有”、“无”),原因是_________________________。
(3)试管c中发生反应的化学方程式为_________________________________;
(4)集气瓶e中最后收集到的气体为______________________,理论上该气体的总体积为_________L(标准状况时),实际上这个数值________________(填“大”“小”)在3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O中,表现氧化性的HNO3和表现酸性的HNO3的质量之比为 [ ] A.1:2
B.1:3
C.2:3
D.1:1下列关于硝酸的叙述正确的是 [ ] A.久置的浓硝酸会呈黄色
B.铜与浓硝酸和稀硝酸反应分别生成NO和NO2
C.浓硝酸是强氧化剂,稀硝酸是弱氧化剂
D.稀硝酸与活泼金属反应主要放出H2,而浓硝酸则使金属钝化(1)下列实验方法能达到目的的是______________
A.用饱和Na2SO3溶液除去SO2气体中的SO3气体
B.用浓H2SO4干燥SO2气体
C.食盐中混有少量NH4Cl:加过量烧碱溶液后加热蒸干
D.用Ba(OH)2溶液区分Na2SO3溶液和NaHSO3溶液
(2)由1H、2H、3H、35Cl、37Cl组成的氯化氢分子有________种
(3)在浓硝酸中放入铜片,开始反应的化学方程式为_____________________; 体现了浓硝酸的______性。取三张蓝色石蕊试纸放在玻璃上,然后按顺序滴加65%的HNO3、98.3%H2SO4和新制氯水,三张试纸最后呈现的颜色是 [ ] A.白、红、白
B.红、黑、红
C.红、红、红
D.白、黑、白下图中每一个方格表示有关的一种反应物或生成物(部分的产物已省略);X加热产生A、B、C三种物质,其中A、C为无色气体,B在常温下是一种无色的液体;X与NaOH溶液在加热作用下产生一种能使湿润的红色石蕊试纸变蓝的气体C;X与HCl反应产生一种无色无味的气体A,它能使澄清石灰变浑浊;请填下列空白 
(1)物质x可以是__________或__________,C是__________,F是__________。(填写化学式)
(2)反应①的化学方程式______________________________。
(3)G的浓溶液与木炭反应的化学方程式______________________________。下列说法正确的是 [ ] A.浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸
B.向某溶液中加入氯化钡溶液和稀硝酸,生成白色沉淀,不能确定原溶液含有SO42-
C.向某溶液中加入氢氧化钠溶液,加热,用湿润的蓝色石蕊试纸检验生成的气体,若试纸变红色,则说明原溶液中一定含有NH4+
D.氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气可与淀粉反应下列反应中,相关示意图像错误的是 [ ] A.将二氧化硫通入到一定量氯水中 
B.将氨水滴入到一定量氯化铝溶液中
C.常温下将铜粉加入到一定量浓硝酸中
D.常温下将铁粉加入到一定量浓硝酸中
对下列事实的解释正确的是 [ ] A.浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸
B.向某溶液中加入氯化钡溶液和稀硝酸,生成白色沉淀,则原溶液一定含有硫酸根
C.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化
D.氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气可与淀粉反应通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是 [ ] 现象 解释
A.浓HNO3在光照条件下变黄 浓硝酸不稳定,生成有色产物能溶于浓硝酸
B.KI淀粉溶液中通入Cl2,溶液变蓝 Cl2能与淀粉发生显色反应
C. 说明该溶液中含有SO42-
说明该溶液中含有SO42-
D.向盐酸中加入浓硫酸时产生白雾 说明浓硫酸具有脱水性在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质是行测定,测得如下数据 
请回答下列问题
(1)上表中“等测数据”的数值是___________,此密闭容器中化学反应类型属于___________反应(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比n(X):n(Y):n(Z):n(Q)=2:4:4:1,写出化学反应的方程式:_________________________________。
(3)反应结束后,若将反应体系内的Y物质取出,要标准状况下测得其体积小于11.2L,其原因是
______________________。下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是 [ ] A.CuO+2HNO3=Cu(NO3)2+H2O
B.FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C.C+4HNO3=CO2↑+2H2O+4NO2↑
D.NH3+HNO3=NH4NO3雷雨中含微量的HNO3,用化学方程式解释HNO3的形成过程
________________、________________、________________下列说法正确的是 [ ] A.等质量的浓硝酸和稀硝酸与铜反应,生成的气体浓硝酸多
B.王水是浓硝酸和浓盐酸按3:1的体积比组成的混合物,能溶解金、铂
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨水可使酚酞试剂变为红色,说明氨水显碱性对于下列事实的解释错误的是 [ ] A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显弱碱性下列现象或事实可用同一原理解释的是 [ ] A.氯水和SO2使品红溶液褪色
B.浓硫酸和浓硝酸长期暴露在空气中浓度降低
C.浓硫酸和浓硝酸都可以用铁质容器储运
D.SO2可使品红和酸性高锰酸钾溶液褪色下列反应中,调节反应物用量或浓度不会改变反应产物的是 [ ] A.CO2通入Ca(OH)2溶液
B.AlCl3溶液中滴入NH3·H2O溶液
C.HNO3中加入Cu粉
D.HCl溶液滴入Na2CO3溶液某铜粉样品含少量金(Au),不含其他成分。测定该样品中金的含量时,有两种溶解样品的方法:
①用稀硝酸溶解样品,②用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl =
CuCl2+2H2O,已知金不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式______________________。
(2)在铜与双氧水、盐酸的反应中氧化剂是_____________,若有2mol的H2O2参加反应,则转移电子数是_____________。
(3)方法①和②相比较,你认为哪种更好?_____________。理由是__________________________。以铜、硝酸、硝酸银、水、空气为原料,可用多种方法制取硝酸铜。
(1)列举4种方法,用化学方程式表示?
(2)从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上哪种方法,并说明原因。写出下列反应方程式
(1)实验室制取氨气的化学方程式_____________________
(2)浓硝酸呈黄色的原因是(写化学方程式)____________________
(3)铜和稀硝酸反应的离子方程式________________________
(4)铜与浓硝酸的反应的化学方程式________________________
(5)Na2CO3溶于水显碱性的原因(用离子方程式表示)____________________下列关于硝酸的相关说法不正确的是 [ ] A.浓硝酸常呈黄色,除去黄色最适宜的方法是通入空气
B.通常保存硝酸用棕色细口瓶,并置于阴暗处
C.铜粉加入稀硫酸,加热后无明显现象,当加入KNO3后,铜粉质量减少,溶液呈蓝色,有气体逸出 D.一定量的浓硝酸与过量的铜粉充分反应,生成的气体只有NO2下列有关实验操作、现象和解释或结论都正确的是 [ ] 实验操作 现象 解释或结论 A. 过量的Fe粉中加入HNO3, 充分反应后,
滴入KSCN溶液溶液呈红色 稀HNO3将Fe氧化为Fe3+ B. AgI沉淀中滴入稀KCl溶液 有白色沉淀出现 AgCl比AgI更难溶 C. Al箔插入稀HNO3中 无现象 Al箔表面被HNO3氧化,
形成致密的氧化膜D. 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 试纸变蓝色 浓氨水呈碱性 下列对于硝酸的认识中不正确的是 [ ] A.浓HNO3和稀HNO3都具有强氧化性
B.铜与HNO3的反应属于置换反应
C.金属与HNO3反应一般不产生氢气
D.可用铁或铝制容器盛装浓HNO3下列有关硝酸的说法正确的是 [ ] A.Cu与浓硝酸反应所得溶液的颜色为蓝绿色,说明一定有一部分NO2溶解在溶液中
B.浓硝酸见光分解,其产物能使带火星的木条复燃
C.Cu与稀硝酸反应后,在容器口观察到红棕色气体,证明还原产物为NO2
D.含0.2mol HNO3的浓硝酸与足量Cu反应可以得到0.1 molNO2气体有关物质的性质与用途的关系叙述中不正确的是 [ ] A.过氧化氧可用作消毒剂是因为过氧化氢有氧化性
B.硝酸可用于制造炸药是因为硝酸有强氧化性
C.氮气可用作保护气是因为氮气性质不活泼
D.氮化硅陶瓷可用于制造新型柴油发动机是因为氮化硅陶瓷有较高的熔点下列叙述正确的是 [ ]
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价下列各组物质发生化学反应:①Fe+ O2②P+Cl2 ③HNO3+Cu④Na+O2⑤Cu+S⑥P2O5+H2O⑦H2S+O2
⑧C+O2⑨C2H5OH +O2⑩NH3+ O2在不同条件下能得到不同产物的是[ ] A.全部
B.除⑨⑩外的其他组
C.除②④外的其他组
D.除⑤外的其他组物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是[ ] A.①③
B.③④
C.①②
D.①③④化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是 [ ] ①过量的锌与18 mol/L的硫酸反应;
②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2;
④过量铜与浓硫酸;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与块状石灰石
A. ②③④⑥
B. ②③⑤
C. ①④⑤
D. ①②④④⑤⑥下列有关元素及其化合物的叙述正确的是 [ ] A. C、P分别在足量氧气中燃烧均生成一种相应氧化物
B. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C. 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
D. SO2、SO3均能与氯化钡溶液反应生成白色沉淀金属(M)的腐蚀是因为发生反应:M-ne-→Mn+。金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡。但是加热或在稀HNO3中,铁与硝酸会不断反应。不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。钢铁在冷的浓硝酸中浸泡能防腐的原因是__________________。
(2)工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是_________________。
(3)由图示可知,密度等于1. 35 g/mL的硝酸与铁反应时,其还原产物主要是_____________;足量的铁与一定量的浓硝酸反应时,反应过程中可能的气体产物有________;还原产物中NH4+的物质的量分数随
_______而增大;请用一句话概括该图反映出的基本结论:_______________。
(4)mmol铁与极大量的密度为1.35 g/mL的硝酸溶液完全反应放出nL气体(体积在标准状况下测定),此时溶液中Fe元素的存在方式是___________,n的值最接近_____(填字母编号)。
A.22. 4m B.33. 6m C.44. 8m D.67. 2m如图所示,向一定量的铁粉中加入一定体积12 mol/L的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是 
[ ]
①NO3- ②Fe3+ ③H+ ④NO ⑤NO2
A.只有①
B.①⑤
C.②④⑤
D.①②③⑤化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度来看,不恰当的一种物质是_______。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式______________________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是____。
A.Ag B.Cu C.Al D.Fe
(4)烧碱、纯碱均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,
①分别是:________;Na2CO3;__________;NaHCO3。
②将得到的固体重新溶解于水,在溶液中加盐酸,使溶液的pH =7,再将溶液蒸干,得到固体的质量是
____g。某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了下图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜 
填写下面空白:
(1)图中标号处需加入的相应物质分别是①_______、②______、③_______、④_______、⑤_______;
(2)写出①处发生反应的离子方程式____________________、_________________、__________________、
_________________;写出③处发生反应的化学方程式________________________;
(3)铁红的化学式为_________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红_________;氧化铜__________。下列对于硝酸的认识,正确的是 [ ] A.浓硝酸和稀硝酸都具有氧化性
B.铜和稀硝酸反应属于置换反应
C.在铜和浓硝酸的反应中,硝酸只表现了氧化性,没有体现酸性
D.可用铝质或铁质容器盛装稀硝酸最新试题- 1如果父母做出不道德的事,我们要[ ]A.替父母隐瞒B.勇于批评 C.把父母送上法庭D.宽恕、包容父母
- 2如图所示,下列器件中属于省力杠杆的是( )
- 3补写出下列名篇名句中的空缺部分。小题1:遥岑远目,献愁供恨, 。(辛弃疾《水龙吟•登建康赏心亭》)小题2
- 4已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L
- 5戊戌变法的结局表明A.改良主义道路在半殖民地半封建的中国走不通B.维新派缺乏坚强的组织领导C.维新派势力过于弱小D.维新
- 6We don’t believe _____ little children can do ____ much work
- 7下列四个区域与其农业发展方向匹配合理的是( )A.东北平原——开垦沼泽地 B.东南丘陵——发展茶园果园C.华北平原——
- 8解不等式组:
- 9— The girl _____ all her savings to the people in the Southw
- 10下列过程,不需要破坏化学键的是( )A.钠与水反应B.干冰升华C.碳酸氢钠受热分解D.HCl气体溶于水
热门考点- 1根据句意及首字母提示完成单词1. The computer is a little e____ . I can"t a
- 2如图所示,压缩的弹簧将小球弹起,使小球上升到一定高度.以下分析正确的是( )A.弹簧将小球弹起,说明力的作用效果是可以
- 3抗日战争期间,中国军队主动出击,毙伤俘日伪军达4万多人的战役是( )A.平型关大捷B.百团大战C.淞沪会战D.徐州会
- 4下列命题正确的是( )A.用正六边形能镶嵌成一个平面B.有一组对边平行的四边形是平行四边形C.正五角星是中心对称图形D
- 5生物在进化的过程中,各种器官不断地得到完善,以适应生存的环境.下列给出的动物器官中,有减小压强功能的是( )A.啄木鸟
- 6下列说法中错误的是A.键长愈长,化学键愈不牢固B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素C.除氦外的稀
- 7 瑞蚨祥是全国知名的百年绸布老字号,该公司的发展几乎浓缩了中国近现代企业发展的整个历程。阅读下列材料,回答
- 81992年,党的十四大提出要使市场在国家宏观调控下对资源配置起基础性作用,十八届三中全会把市场在资源配置中的“基础性作用
- 9蒙古族是祖国大家庭中的重要成员,长期生活在蒙古高原上。统一了蒙古各部落的是[ ]A.阿保机B.阿骨打 C.忽必烈
- 10在物质和运动的关系上,下列说法中正确的是[ ]A、万物都在运动,但只是在概念中运动B、世界上存在脱离物质的运动C
版权所有 CopyRight © 2012-2019 超级试练试题库 All Rights Reserved.




