百科
氧化铝
性质
物理性质:白色固体,熔点高,是较好的耐火材料,天然的Al2O3叫刚玉,硬度仅次于金刚石;
化学性质:不溶于水的两性化合物,既能与酸反应,又能与强碱反应。
(1)与酸反应: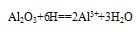
(2)与碱反应: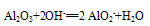
氧化铝的两性
氧化铝属于两性氧化物,既能与酸反应,也能与强碱反应:
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-===2AlO2-+H2O
相关试题
在一定条件下可实验下图所示物质之间的变化 
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。上图中的F是____________。
(2)写出明矾与过量NaOH溶液反应的离子方程式:__________________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式________________________________。
(4)每生成1molD,同时生成____________molE。工业制备铝一般是从铝土矿(主要成分是Al2O3,含有杂质Fe2O3)中得到纯净的Al2O3,然后是电解
Al2O3得到铝。下图是从铝土矿中提纯是的简单示意图。其中牵涉到的一个反应是:

(1)写出图示中(1)的实验操作是______________;图示中(2)加入的试剂______________。
(2)试推断物质(写化学式)B_________;C_________;H__________;F____________。
(3)写出化学方程式: ①_______________________。④_______________________。甲、乙、丙三种物质之间有如下转化关系 
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是____________ ;写出乙→丙转化的化学方程式:___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________________________;写出 甲→乙转化的离子方程式_________________________________________。下列叙述正确的是 [ ] ①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用作红色油漆和涂料
③硅酸钠是制备硅胶和木材防火剂的原料
④以纯碱、石灰石、石英为原料可制普通玻璃
⑤石灰石、高岭石、石英和水晶的主要成分都是SiO2
A.①③④⑤
B.②③④⑤
C.①②④⑤
D.①②③④写出下列反应的离子方程式:
(1)Al2O3溶于NaOH溶液:_______________________
(2)Al与NaOH溶液反应:_______________________(1)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与烧碱溶液反应。
① 若X为氧化物,X的化学式是____________。
② 若X为单质,X用于焊接钢轨反应的化学方程式是_________________________。
③ 若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。X与稀硫酸反应的离子方程式是_________________________;X与足量稀氢氧化钠溶液反应的离子方程式是_________________________。
(2)科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是_________________________。下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 
(1)④、⑤、⑥的原子半径由大到小的顺序是___________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解, 可使用的催化剂为(填序号)__________________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: 
X溶液与Y溶液反应的离子方程式为_____________________________________________,
N→⑥的单质的化学方程式为___________________________________,
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________________。关于下列金属氧化物的用途中,说法正确的是 [ ] A.氧化铁是一种红棕色的粉末,能与氢氧化钠溶液反应,常用于制造红色油漆和涂料
B.氧化铝是一种白色难熔的物质,是较好的耐火材料,常用于制造耐火坩埚和耐火管
C.氧化铜呈黑色,能溶于水,可作为制造铜盐的原料
D.氧化亚铜呈蓝色,可作为制造玻璃、搪瓷的颜料A.B、C、D是原子序数依次增大的短周期元素,化合物AC2与B2C具有相同的电子数,A、B的质子数之和与D的质子数相同,D与C形成的化合物既能与强酸反应又能与强碱反应,回答下列问题:
(1)写出D的原子结构示意图_________,AC2的电子式___________。
(2)写出D与C形成的化合物与强碱反应的离子方程式____________________。
(3)14g、化合物AC与足量的C2单质反应放出141.5 kJ的热量,该反应的热化学方程式为____________。
(4)B的最高氧化物对应的水化物M,M与第四周期常见金属X有如下转化关系
写出Y与M的稀溶液反应的离子方程式____________________。Z溶液显_______性,其原因用离子方程式表示为____________________。 下列说法正确的是 [ ] A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸碱溶液反应
D.Al2O3能跟强的酸碱溶液反应下列说法正确的是 [ ] A.Al2O3与水反应生成Al(OH)3
B.Al2O3熔点很高,可作耐火材料
C.Al(OH)3易溶于NaOH溶液和氨水中
D.Al(OH)3是白色胶状沉淀,是一种弱碱下列关于Al2O3的说法正确的是 [ ] A.Al2O3也可以通过分解反应制得
B.Al2O3是两性氧化物
C.Al2O3非常致密,所以可用铝制容器盛盐酸和NaOH溶液等
D.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝纷纷滴落下来下列有关物质用途的说法中,不正确的是 [ ] A.液氨可用作制冷剂
B.氯气可用于制漂白液
C.氧化铝可用于制造耐高温的实验仪器
D.氧化钠可用作呼吸面具中氧气的来源①Al2O3 ②KIO3 ③CH3CH2OH ④  。
。
根据所学知识,请你在上述四 种物质中选择合适物质的编号填入下列空格中。
(1)可用作医用消毒剂的是____。
(2)具有两性的氧化物是____。
(3)难溶于水的有机物是____。
(4)加碘食盐中含有的是____。下图所示转化关系中,B、C、F都是单质,其中C是紫红色固体,F是银白色固体,B是空气的主要成分之一;化合物G是常用的耐火材料,D溶液中加入氯化钡溶液,产生白色沉淀。 
试回答下列问题:
⑴反应①~④中,属于置换反应的是________(填序号)。
⑵写出反应①的化学方程式________________________________。
⑶G与D溶液反应的离子方程式__________________________________。
⑷生成等物质的量的B时,反应①和③消耗的A、G的物质的量之比为________。
⑸用C、F作两电极,并用导线相连: ①两电极同时插入稀H2SO4中,F上的电极反应式为
___________________________。
②两电极同时插入浓HNO3中,F上的电极反应式为_____________________________。下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是 [ ] ①Na2SiO3;②AlCl3;③NH4HCO3;④Al2O3;⑤NaHSO4
A.①②④
B.②③⑤
C.②③
D.③④用电除尘法可除去火力发电厂烟囱中大量的粉煤灰。已知粉煤灰的主要成分如下表,从粉煤灰中能够获得Al2O3。某校研究性学习小组设计了如图所示的提取Al2O3的工艺流程图。 

请回答下列问题。
(1)上述氧化物中能与NaOH溶液反应的是___。
(2)①固体I中含有的主要物质的化学式为__。
②向溶液Ⅱ中通人过量的CO2,发生反应的离子方程式为___。
(3)电解氧化铝制备金属铝时常常需加入冰晶石,冰晶石的作用是___,电解氧化铝的化学方程式为________,理论上从1t粉煤灰中可得到铝的质量为__。化学对人类社会进步和发展的贡 献之一是发现和研制了各种材料,例如金属就是我们生活中不可或缺的重要材料, 根据你学过的有关金属的知识,回答下列问题:
(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是____(填序号)。
A.铜的熔点不是太高,易于冶炼,铸造成型
B.铜的性质不活泼,不易被腐蚀
C.我国较早地掌握了湿法冶炼铜的技术
D.自然界有大量的游离态的铜
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是____(填名称),铁的氧化物常见的还有____、____、(填化学式)。
(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为___。取少量MgO、  的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述正确的是
的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述正确的是[ ] A.上述四种氧化物对应的水化物中  酸性最强
酸性最强
B.向沉淀X中加入氢氟酸,沉淀X不溶解
C.溶液Y中的阳离子主要是
D.溶液Y中加入氨水,所得沉淀为
以氧化铝为原料制取氢氧化铝,最好的方法是 [ ] A.将氧化铝溶于水
B.将氧化铝先溶于盐酸中,之后滴加氨水
C.将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液
D.将氧化铝溶于氢氧化钾铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下图所示,请回答有关问题: 
(1)流程乙加入烧碱后发生反应的离子方程式:________________;______________。
(2)溶液D到沉淀E发生的离子方程式_____________________ 。
(3)验证滤液B含Fe3+,可取少量滤液并加入________。
(4)滤液K中溶质的主要成份是__________(填化学式)。下列化学实验事实及其结论都正确的是( ) A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4 强 C.FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu D.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性 下列实验现象、操作或反应原理的解释正确的是( ) 现象、操作或反应 解释 A铝箔在酒精灯火焰上加热熔化不滴落 铝箔对熔化的铝有吸附作用 B向滴有稀硫酸的热淀粉液中滴加碘水,
液体呈蓝色此条件下淀粉没有完全水解 C向pH试纸上滴加氯水,先变红后褪色 氯水显酸性 D鸡蛋清溶液遇乙酸铅溶液会产生沉淀 蛋白质发生盐析 用坩锅钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落.下列关于上述实验现象的解释正确的是( ) A.火焰温度太低不能使铝燃烧 B.铝在空气种能很快形成氧化膜 C.氧化铝的熔点比铝的熔点高 D.用酸处理时未能将氧化铝溶解 某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:______.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是______. 用离子方程式解释产生气泡的原因:______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是______.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:选项 铝电极 电解质 负极反应 正极反应 A 正极 NaOH Al-3e-=Al3+ 2H2O+2e-=2OH-+H2↑ B 负极 稀盐酸 2Al-6e-=2Al3+ 6H++6e-=3H2↑ C 正极 浓硝酸 Cu-2e--=Cu2+ 2NO3-+4H+-4e-=2NO2↑+2H2O D 负极 稀硝酸 Cu-2e-=Cu2+ 2NO3-+8H+=2NO↑+4H2O+6e- 下列现象或反应的原理解释正确的是( ) 选项 现象或反应 原理解释 A 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔对熔化的铝有较强的吸附作用 B 合成氨反应需在高温条件下进行 该反应为吸热反应 C 镀层破损后,镀锡铁比镀锌铁易腐蚀 锡比锌活泼 D 2CO=2C+O2在任何条件下均不能自发进行 该反应△H>0,△S<0 下列现象或反应的原理解释正确的是( )
A.铝箔在酒精灯火焰上加热熔化但不滴落,原理解释:铝箔对熔化的铝有较强的吸附作用
B.HF的沸点高于HCL,原理解释:H-F的键厂比H-CL的键长短
C.2CO-=2C+O2在任何条件下均不能自发进行,原理解释:该反应△H>0、△S<0
D.氨气溶于水形成的溶液能导电,原理解释:氨气是电解质在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应.这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致.为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象.
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol•L-1盐酸、1.5mol•L-1硫酸、3.0mol•L-1硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol•L-1盐酸、1.5mol•L-1硫酸、3.0mol•L-1硫酸,观察反应进行到1,2,5,15,20分钟时的铝与酸反应的情况.结果如下:反应进程(分钟) 1 2 5 15 20 3.0mol/L盐酸 少量气泡 较多气泡 大量气泡 反应剧烈 铝片耗尽 1.5mol/L硫酸 均无明显现象(无气泡产生) 3.0mol/L硫酸 均无明显现象(无气泡产生) 某化学学习小组对铝与酸和碱的反应进行探究,过程如下.
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的______(填写相应的字母);
a.盐酸的物质的量浓度大于硫酸的物质的量浓度
b.Cl-能促进此反应的进行
c.SO42-能抑制此反应的进行
d.硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分.
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸.
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的______(填写相应的试剂,下同),再向其中的一支试管中加入适量的______固体,并振荡使固体溶解,观察实验现象.
实验探究:略.
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者______后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为______;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的.
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物.
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
1向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解.实验时发现固体完全溶解,证明猜想______一定不正确(填“1”、“2”、“3”、“4”).
②向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解.实验时发现固体完全溶解,证明猜想______一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想______(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:______.下列与化学实验有关的叙述正确的是( )


 乙
乙 丙
丙 甲,则甲不可能是
甲,则甲不可能是