百科
化学平衡状态的判断
状态判断
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到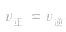 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
判断

相关试题
在一定温度下,A2(g) + B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
①单位时间内减少x mol A2,同时生成2x mol AB;
②单位时间内生成 2x mol AB, 同时生成x mol A2;
③反应混合物中,A2、B2、AB的物质的量比为1:1:2;
④单位时间内1mol A-A键断裂,同时形成2 mol A-B键;
⑤单位时间内减少1mol A2,同时断裂2 mol A-B键;
⑥反应混合物中,AB的质量分数不再改变。[ ] A.①③④
B.②⑤⑥
C.②④⑥
D.①⑤⑥在一定温度下的定容密闭容器中,下列说法能表明反应:A(s)+2B(g)  C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是[ ]
A.混合气体的压强不变
B.消耗2molB的同时生成1molC
C.混合气体的相对分子质量不变
D.气体的总物质的量不变下列说法中可以说明N2+3H2  2NH3已达平衡的是
2NH3已达平衡的是[ ] A.在一个N≡N键断裂的同时,有3个H-H键断裂
B.在一个N≡N键断裂的同时,有2个N-H键断裂
C.在一个N≡N键断裂的同时,有6个N-H键断裂
D.在一个N≡N键断裂的同时,有6个N-H键形成在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生2NO+ O2  2NO2,反应达到平衡的标志是
2NO2,反应达到平衡的标志是 [ ]
A. NO、O2、NO2分子数目比是2:1:2
B. 反应混合物中各组分物质的浓度相等
C. 混合气体的颜色不再变化
D. 混合气体的密度不再改变可逆反应:  在密闭容器反应,达到平衡状态的标志是
在密闭容器反应,达到平衡状态的标志是[ ] (1)单位时间内生成n mol O2的同时,生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(4)(5)
B.(2)(3)(5)
C.(1)(3)(4)
D.(1)(2)(3)(4)(5)已知N2(g)+3H2(g)  2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是 [ ] A.最终可以生成2mol NH3
B.达到化学平衡状态时,正反应和逆反应的速率都为0
C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2
D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是 
[ ] A.反应的化学方程式为:2M  N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍某温度下,在一固定容积的容器中进行如下反应N2+3H2  2NH3,下列情况一定能说明反应已达到限度的是:_____________________。(填序号)
2NH3,下列情况一定能说明反应已达到限度的是:_____________________。(填序号)
① 容器内气压不随时间变化
② 1个N≡N键断裂的同时,有6个N-H键断裂
③ 用N2、H2、NH3的物质的量浓度变化表示化学反应速率的比为1:3:2
④ 容器内气体密度不再改变
⑤ 混合气的平均相对分子质量不随时间变化0℃时,将0.1mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是 [ ]
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2的生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.②③⑥⑦
B.①④⑧
C.只有①④
D.只有⑦⑧已知汽车尾气无害化处理反应为  下列说法不正确的是
下列说法不正确的是[ ] A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡在一定温度下,可逆反应A(g)+3B(g)  2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是[ ] A.C生成的速率与A分解的速率相等
B.单位时间生成nmol A,同时生成3nmol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1∶3∶2可以证明可逆反应N2(g)+3H2(g)  2NH3(g)已达平衡状态的是:
2NH3(g)已达平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂;
②一个N≡N键断裂的同时,有6个N-H键断裂;
③其他条件不变时,混合气体的总质量不变;④恒温恒容下的反应,体系压强不再改变;
⑤反应体系中反应物和生成物的百分含量都不再改变;
⑥恒温恒压下的反应,密度不再改变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)[ ] A.全部
B.②④⑤⑥⑦
C.②③④⑤⑥⑦
D.③④⑤⑥⑦对于可逆反应M+3N  2Q达到平衡时,下列说法正确的是
2Q达到平衡时,下列说法正确的是 [ ] A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物各组分的浓度不再变化
D.反应已经停止一定温度下,可逆反应2NO2  2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成nmolO2的同时生成2nmolNO2;
②单位时间内生成nmolO2的同时生成2nmolNO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤密闭容器中压强不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。[ ]
A.①④⑤⑥
B.②③⑤⑥
C.①③④⑥
D.全部可逆反应N2+3H2  2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是 [ ] A.2v正(H2)=3v逆(NH3)
B.v正(N2)=v逆(NH3)
C.v正(N2)=3v逆(H2)
D.v正(N2)=v正(H2)可逆反应2NO2(g)  2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是[ ] ①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③NO2、NO、O2的物质的量浓度比值为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的总压强不再改变的状态
A.①④⑥
B.②③⑤
C.①③④
D.全部在一定温度的定容密闭容器中,反应A2(g)+B2(g)  2AB(g)达到平衡状态的是
2AB(g)达到平衡状态的是[ ]
A.混合气体的密度不再改变
B.容器内的总压强不随时间而变化
C.单位时间内生成2nmol AB的同时,生成nmol的B2
D.A2、B2、AB的分子数之比为1:1:2时某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示。由图中数据分析: 
(1)该反应的化学方程式为___________________________。
(2)反应开始至2min,用Z表示的平均反应速率为________________。
(3)下列叙述能说明上述反应达到平衡状态的是_______________(填序号)
A.X、Y、Z的物质的量之比为3∶1∶2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素
①B元素的原子最外层电子数是次外层电子数的两倍,
②C的最高价氧化物的水化物和氢化物反应生成盐
③D和E可以形成1:1和1:2的两种常见化合物。
④A与C元素原子的电子层数相差1,且与E是同主族元素
⑤原子半径由大到小顺序是E>F>G>B>C>D>A
⑥F是同周期中离子半径最小的元素,G是同周期中原子半径最小的元素
回答:
(1)由B、D、E三元素组成的无机盐水溶液呈碱性,其原因是(用离子方程式表示)___________________________________
(2)A的单质和D的单质可以设计为新型燃料电池,电解质为KOH溶液,则A的单质在该燃料电池中发生的电极反应式为__________________________。
(3)当反应3A2(g)+C2(g) 2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是__________________。
2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是__________________。 
(4)D和E能形成1:1和1:2的两种常见化合物X和Y :写出Y与水反应的离子方程式:_________________________________。若将X、Y分别溶于等量足量的水中,形成浓度相同的溶液,需X、Y的物质的量的关系为: n(X)____________n(Y)(填“<”“>”或“=”)
(5)C、D、E、F、G的简单离子的半径由大到小的顺序是(用元素的离子符号表示)________________
(6)F的最高价氧化物对应水化物的电离方程式为__________________________
(7)用离子方程式说明C与A形成的化合物结合H+能力强于D与A形成的化合物:___________________在一定条件下,可逆反应:A(g)+3B(g)  2C(g)达到平衡的标志是
2C(g)达到平衡的标志是[ ] A.C的生成速率与C的分解速率相等
B.A.B.C的浓度不再变化
C.单位时间内生成nmol A,同时生成3nmol B
D.A.B.C的分子数之比为1:3:2可逆反应在一定条件下达到反应限度(化学平衡状态)的标志是 [ ] A.反应停止了
B.正反应速率与逆反应速率均为零
C.反应物和生成物浓度相等
D.正反应速率与逆反应速率相等在一定条件下,对于密闭容器中进行的可逆反应:  下列说法中,能充分说明这一反应已经达到化学平衡状态的是
下列说法中,能充分说明这一反应已经达到化学平衡状态的是 [ ] A.N2、H2与NH3的物质的量之比为1︰3︰2
B.N2、H2与NH3的浓度相等
C.各组分的浓度不再发生变化
D.反应停止,正、逆反应速率都等于零可逆反应H2(g)+I2(g)  2HI(g)达到平衡时的标志是
2HI(g)达到平衡时的标志是[ ] A.H2、I2、HI的浓度相等
B.1个I-I键断裂的同时,有2个H-I键断裂
C.混合气体的质量不再改变
D.混合气体密度恒定不变一定温度下,在1L的密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是 [ ] A.NH3的生成速率与H2的生成速率相等
B.混合气体的密度不再发生变化
C.N2、H2、NH3的分子数之比为1∶3∶2
D.N2的转化率不再发生改变在一个固定体积的密闭容器中加入2molA,发生可逆反应: 2A(g)  2B(g)+C(g)。该反应达到平衡的标志是
2B(g)+C(g)。该反应达到平衡的标志是[ ] A.容器内压强是开始时的1.5倍
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化哈伯因发明了由N2合成NH3的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol
H2,在一定条件下发生反应:N2+3H2 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是 [ ] A.达到化学平衡时,有2molNH3生成
B.达到化学平衡时,正反应和逆反应的速率均为零
C.达到化学平衡时,N2、H2和NH3的物质的量不再变化
D.达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1∶3∶2在一定条件下,对于密闭容器中进行的可逆反应:N2(g) + 3H2(g)  2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是
2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是 [ ] A.N2、H2、NH3的浓度相等
B.正、逆反应速率都等于零
C.N2、H2、NH3的浓度不再变化
D.N2、H2、NH3在密闭容器中共存在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)  3C(g),只有反应到达平衡时才具有的状态是
3C(g),只有反应到达平衡时才具有的状态是 [ ] A.各物质的浓度之比为2︰3︰3
B.混合物中各物质的浓度相等
C.A、B、C三种物质的浓度不随时间变化而变化
D.υ(A)︰υ(B)︰υ(C) = 2︰3︰3某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据下表中数据,在该题坐标图上画出X、Z的物质的量(n)随时间(t)变化的曲线:(图中已画出Y,用铅笔作图,并在你画出的曲线末端明确标出“x”或“z”)

(2)体系中发生反应的化学方程式是________________________;
(3)列式并计算该反应在0-5min时间内产物Z的平均反应速率:______________________;
(4)该反应在第________________分钟(min)时达到平衡状态;
(5)若使该反应的速率增加,下列措施一定不能达到目的的是________________。
A.升高温度 B.降低温度 C.使用催化剂 D.保持容器体积不变加入lmolx和2moly在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)  2Z(g) , 此反应达到限度的标志是
2Z(g) , 此反应达到限度的标志是 [ ] A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ可逆反应H2(g)+I2(g)  2HI(g)达到平衡时的标志是
2HI(g)达到平衡时的标志是[ ] A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中体积分数不变在一定条件下,密闭容器中可发生可逆反应:N2(g)+3H2(g)  2NH3(g)。下列说法中,表明这一反应已经达到化学平衡状态的是
2NH3(g)。下列说法中,表明这一反应已经达到化学平衡状态的是[ ] A.N2、H2、NH3的浓度相等
B.N2、H2、NH3的浓度不再变化
C.N2、H2、NH3在密闭容器中共存
D.反应停止,正、逆反应速率都等于零可逆反应:2NO2(g)  2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是[ ] ① 单位时间内生成nmol O2的同时生成2nmol NO2
② 单位时间内生成nmol O2的同时生成2nmol NO
③ 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
A.①④
B.②③⑤
C.①③④
D.①②③④⑤可逆反应H2(g)+I2(g)  2HI(g)达到平衡状态时的标志是
2HI(g)达到平衡状态时的标志是[ ] A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2.I2.HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是 
[ ] A.反应的化学方程式:2M  N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍一定条件下,发生可逆反应  。下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是
。下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是[ ] A.NH3的消耗速率等于NO的生成速率
B.NH3的消耗速率等于NO的消耗速率
C.NH3的浓度和NO的浓度都不发生改变
D.密闭容器内的压强不发生改变将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)  2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是 [ ] A.每生成2mol SO2的同时,消耗2mol SO3
B.混合气体的质量不再变化
C.每生成2mol SO3的同时,消耗2mol SO3
D.每生成2mol SO3的同时,消耗1mol O2一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+3B(g)  2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是
2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是[ ] A.单位时间内生成amol物质A,同时生成3amol物质B
B.容器内气体的密度不再随时间而改变
C.C物质的生成速率和分解速率相等
D.A、B、C三种物质的分子数之比为1:3:2一定温度下可逆反应N2(g)+3H2(g)  2NH3(g) 达平衡的标志是
2NH3(g) 达平衡的标志是[ ]
A.v正(N2) = v逆(N2)
B.v正(N2) = 3v正(H2)
C.v正(H2) = 2/3v逆(NH3)
D.N2、H2、NH3的体积比为1︰3︰2当一个可逆反应进行到正反应速率与逆反应速率相等的时候,就达到了“化学平衡”。对于化学平衡的下列说法中正确的是 [ ] ①化学反应达到化学平衡时,反应物与生成物的浓度(含量)保持不变;
②化学反应达到化学平衡时,整个反应处于停滞状态;
③影响化学平衡的外界条件发生改变,平衡状态就会被破坏。
A.只有①
B.只有①②
C.只有①③
D.①②③在一个固定体积的密闭容器中加入2mol A,发生可逆反应:2A(g)  2B(g)+C(g)。该反应达到平衡的标志是
2B(g)+C(g)。该反应达到平衡的标志是[ ] A.容器内A、B、C同时存在
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化在一定的温度下, 可逆反应:A2(g)+B2(g)  2AB(g) 达到平衡的标志是
2AB(g) 达到平衡的标志是[ ] A.容器中的总压强不随时间的变化而变化
B.单位时间内有nmol A2生成同时就有nmol B2生成
C.单位时间内有nmol A2生成同时就有2nmol AB生成
D.单位时间内有nmol B2生成同时就有2nmol AB分解对于可逆反应M+N  Q达到平衡时,下列说法中正确的是
Q达到平衡时,下列说法中正确的是[ ] A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物各组分的浓度不再变化
D.压强不再变化一定温度下反应N2(g)+3H2(g)  2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是[ ]
A.N2、H2和NH3的物质的量浓度不再改变
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时减少2molNH3在一定温度下,下列叙述不是可逆反应A(g)+3B(g)  2C(g)达平衡的标志是
2C(g)达平衡的标志是[ ] (1)C生成速率与C分解速率相等。
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化。
(4)A、B、C的压强不再变化。
(5)混合气体的总压不再变化。
(6)混合气体的物质的量不再变化。
(7)单位时间内消耗amolA,同时生成3amolB
(8)A、B、C的分子数之比为1:3:2。
A.(2) (8)
B.(1) (6)
C.(2) (4)
D.(3) (8)在恒温下的密闭容器中,有可逆反应2NO(气)+O2(气)  2NO2(气)+热量,不能说明已达到平衡状态的是
2NO2(气)+热量,不能说明已达到平衡状态的是[ ] A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变
D.混合气体平均分子量保持不变下列叙述表示可逆反应N2+3H2  2NH3一定处于平衡状态的是
2NH3一定处于平衡状态的是[ ] A.N2、H2、NH3的百分含量相等
B.单位时间,消耗a mol N2的同时消耗3mol H2
C.单位时间,消耗a molN2的同时生成3a mol H2
D.反应若在定容的密器中进行,温度一定时,压强不随时间改变对于固定体积的密闭容器中进行的气体反应可以说明 A(气) + B(气)  C(气)+D(气)在恒温下已达到平衡的是
C(气)+D(气)在恒温下已达到平衡的是[ ] A.反应容器的压强不随时间而变化
B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等
D.反应混合气体的密度不随时间而变化可逆反应H2(g)+I2(g)  2HI(g)达到限度时的标志是
2HI(g)达到限度时的标志是[ ] A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数不变
最新试题
- 1一位学生用如图所示的方法来测定水的折射率,该学生在一个游泳池测得池中水深h="1.2" m(池底水平),用一根竹竿竖直立
- 2已知α,β是方程x2+2008x+1=0的两个根,则(1+2010α+α2)(1+2010β+β2)的值[ ]A
- 32009年7月5日,民族分裂分子热比娅为首的“世维会”借广东韶关事件直接煽动、策划、指挥境内制造了一起打砸抢烧严重暴力犯
- 4制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:2 FeCl3 + Cu = 2FeCl2 + CuCl2
- 5下列叙述不正确的是 [ ]A.天然蛋白质水解的最终产物均为氨基酸 B.油脂水解得到的醇是丙三醇 C.淀粉、纤维素
- 6二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。(1)写出圆底烧瓶中反
- 7已知集合A={m2,2m+1,-3},B={m+2,2m-1,m2+1},若A∩B={-3},则实数m的值是______
- 8 —Would you like to join me for a quick lunch before class?—
- 9下列词语中加粗的字,每对读音都不相同的一项是[ ]A.汜南/侵犯 辞别/城池 坠落/缒城而下 B.
- 10下列选项的表述,不带感情色彩的是A.1789年,巴黎人民发动起义B.1922年,《九国公约》签订C.1929年的经济危机
热门考点
- 1在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4
- 2I am always dreaming of visiting China, and now my dream has
- 3(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为
- 4探究平抛物体的运动规律的实验中,下面做法中可以减小实验误差的是 ( )A.使用密度大、体积小的钢球B.尽量减小钢球与斜
- 5 The notice came around two in the afternoon ________ the me
- 6从高为H处自由下落的物体,不计一切阻力,它的机械能E随高度h变化的图像是[ ]A、B、C、D、
- 7农村中秸秆的综合利用不仅可以提高经济效益,为农民创收,而且还能防止环境污染.现按下列方式处理:已知G是有香味的液体,请回
- 8听下面一段材料,回答第1至3题。1. What is the most probable occupation of t
- 9如图所示为一交流电的电流随时间变化的图象,此交流电的有效值是( )A.AB.5 AC.AD.3.5 A
- 10设全集为U,用集合A、B、U的交、并、补集符号表图中的阴影部分 ______.
